题目内容
【题目】电镀行业产生的酸性含铬废水对环境有污染,其中所含的Cr(VI)是主要污染物,可采用多种方法处理将其除去。
查阅资料可知:
①在酸性环境下,Cr(VI)通常以Cr2O72-的形式存在,Cr2O72-+H2O ![]() 2CrO42-+2H+
2CrO42-+2H+
②Cr2O72-的氧化能力强于CrO42-
③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
阳离子 | Fe3+ | Fe2+ | Cr3+ |
开始沉淀的pH | 1.9 | 7.0 | 4.3 |
沉淀完全的pH | 3.2 | 9.0 | 5.6 |
I.腐蚀电池法
(1)向酸性含铬废水中投放废铁屑和焦炭,利用原电池原理还原Cr(VI)。下列关于焦炭的说法正确的是________(填字母序号)。
a. 作原电池的正极 b. 在反应中作还原剂 c. 表面可能有气泡产生
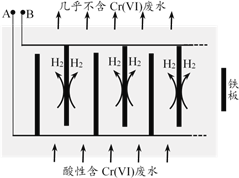
II.电解还原法
向酸性含铬废水中加入适量NaCl固体,以Fe为电极电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准。装置如右图所示。
(2)A极连接电源的________极,A极上的电极反应式是________。
(3)电解开始时,B极上主要发生的电极反应为2H++2e-=H2↑,此外还有少量Cr2O72-在B极上直接放电,该反应的电极反应式为________。
(4)电解过程中,溶液的pH不同时,通电时间(t)与溶液中Cr元素去除率的关系如右图所示。

①由图知,电解还原法应采取的最佳pH范围为________。
a. 2 ~ 4 b. 4 ~ 6 c. 6 ~ 10
②解释曲线I和曲线IV去除率低的原因:________。
【答案】 ac 正 Fe – 2e- ![]() Fe2+ Cr2O72- + 6e- + 14H+ 2Cr3+ + 7 H2O b 曲线I的pH较小,此时Cr(IV)被还原生成的Cr3+难以生成Cr(OH)3沉淀,仍以Cr3+存在于溶液中,导致去除率较低;曲线IV的pH较大,铬元素主要以CrO42-存在,其氧化能力弱于Cr2O72-,Cr(IV)难以被还原继而生成沉淀,导致去除率较低
Fe2+ Cr2O72- + 6e- + 14H+ 2Cr3+ + 7 H2O b 曲线I的pH较小,此时Cr(IV)被还原生成的Cr3+难以生成Cr(OH)3沉淀,仍以Cr3+存在于溶液中,导致去除率较低;曲线IV的pH较大,铬元素主要以CrO42-存在,其氧化能力弱于Cr2O72-,Cr(IV)难以被还原继而生成沉淀,导致去除率较低
【解析】I.(1). 向酸性含铬废水中投放废铁屑和焦炭,利用原电池原理还原Cr(VI),Fe在反应中失电子作负极,则焦炭为正极,正极材料被保护,Cr2O72-在正极得到电子生成Cr3+,当Cr2O72-完全反应后,溶液中的H+也可能在正极得到电子生成H2,故答案为:ac;
II. (2). 向酸性含铬废水中加入适量NaCl固体,以Fe为电极电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,因Fe为电极进行电解时,阳极是活性电极,则Fe失电子,由装置图可知,A为阳极,则A连接电源的正极,在A极上发生的反应为:Fe – 2e- = Fe2+,故答案为:正;Fe – 2e- = Fe2+;
(3). 根据题目信息可知,Cr2O72-在B极上得电子生成Cr3+,该反应的电极反应式为Cr2O72- + 6e- + 14H+ = 2Cr3+ + 7 H2O,故答案为:Cr2O72- + 6e- + 14H+ = 2Cr3+ + 7 H2O;
(4). ①. 据图可知,当溶液的pH处于4~ 6时,Cr元素去除率较高,故答案为:b;
②. 根据题中所给阳离子以氢氧化物形式沉淀时溶液的pH可知,曲线I的pH较小,此时Cr(IV)被还原生成的Cr3+难以生成Cr(OH)3沉淀,仍以Cr3+存在于溶液中,导致去除率较低,曲线IV的pH较大,铬元素主要以CrO42-存在,其氧化能力弱于Cr2O72-,Cr(IV)难以被还原而生成沉淀,导致去除率较低,故答案为:曲线I的pH较小,此时Cr(IV)被还原生成的Cr3+难以生成Cr(OH)3沉淀,仍以Cr3+存在于溶液中,导致去除率较低;曲线IV的pH较大,铬元素主要以CrO42-存在,其氧化能力弱于Cr2O72-,Cr(IV)难以被还原继而生成沉淀,导致去除率较低。

 名校课堂系列答案
名校课堂系列答案【题目】Ⅰ、氨气是重要化工原料,在国民经济中占重要地位。工业合成氨的反应为:N2(g)+3H2(g)![]() 2NH3(g) △H<0。右图表示合成NH3反应在某段时间t0→t6中反应速率与反应过程的曲线图,t1、t3、t4时刻分别改变某一外界条件,则在下列到达化学平衡的时间段中,NH3的体积分数最小的一段时间是(填写下列序号,下同)_______,化学平衡常数最大的一段时间是________。
2NH3(g) △H<0。右图表示合成NH3反应在某段时间t0→t6中反应速率与反应过程的曲线图,t1、t3、t4时刻分别改变某一外界条件,则在下列到达化学平衡的时间段中,NH3的体积分数最小的一段时间是(填写下列序号,下同)_______,化学平衡常数最大的一段时间是________。
a. t0→t1 b.t2→t3 c.t3→t4 d.t5→t6
t4时改变的条件是_______________。

Ⅱ、已知反应:Fe(s)+CO2(g) ![]() FeO(s)+CO(g) H=akJ·mol-1测得在不同温度下,该反应的平衡常数K值随温度的变化如下表所示:
FeO(s)+CO(g) H=akJ·mol-1测得在不同温度下,该反应的平衡常数K值随温度的变化如下表所示:
温度/℃ | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.40 |
(1)若在500℃2L密闭容器中进行该反应,CO2起始量为4mol,5min后达到平衡状态,则这段时间内,用CO表达的反应速率为__________.(填写计算所得数值及单位)
(2)下列图像符合该反应的是_____________(填序号)(图中v代表速率、ω代表混合物中CO的含量,T代表温度)。


(3)下列能说明此反应在500℃达到平衡状态的是___________
①CO的体积分数不变
②固体质量不变
③恒压条件下,气体的体积不变
④恒容条件下,容器内压强不再改变
⑤c(CO)=c(CO2)
【题目】下列离子方程式正确的是( )
选项 | 实验操作 | 离子方程式 |
A | FeCl3溶液和KI溶液反应 | 2Fe3++2I-=2Fe2+ +I2 |
B | A1C13溶液中加入足量的氨水 | A13++30H- = Al(OH)3 |
C | 氯气溶于水 | Cl2 + H20=2H+ +CI-+CIO- |
D | 向稀HN03中滴加Na2S03溶液 | SO2- + 2H+=SO2 |
A. A B. B C. C D. D

