题目内容
【题目】氨在工农业生产中应用广泛,可由N2、H2合成NH3。
(1)天然气蒸汽转化法是前获取原料气中H2的主流方法。CH4经过两步反应完全转化为H2和CO2,其能量变化示意图如下:

结合图像,写出CH4通过蒸汽转化为CO2和H2的热化学方程式______________________。
(2)利用透氧膜,一步即获得N2、H2,工作原理如图所示(空气中N2与O2的物质的量之比按4∶1计)
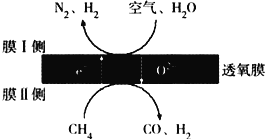
①起还原作用的物质是_________________________。
②膜I侧所得气体![]() =2,CH4、H2O、O2反应的化学方程式是______________________。
=2,CH4、H2O、O2反应的化学方程式是______________________。
(3)甲小组模拟工业合成氨在一恒温恒容的密闭容器中发生如下反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH< 0。t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示,下列说法正确的是____________
2NH3(g) ΔH< 0。t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示,下列说法正确的是____________

A.Ⅰ、Ⅱ两过程到达平衡时,平衡常数:KⅠ<KⅡ
B.Ⅰ、Ⅱ两过程到达平衡时,NH3的体积分数:Ⅰ<Ⅱ
C.Ⅰ、Ⅱ两过程到达平衡的标志:混合气体密度不再发生变化
D.t2时刻改变的条件可以是向密闭容器中加N2和H2混合气
(4)乙小组模拟不同条件下的合成氨反应,向容器充入9.0molN2和23.0molH2,图为不同温度下平衡混合物中氨气的体积分数与总压强(P)的关系图。
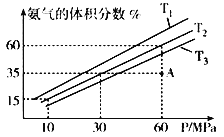
①T1、T2、T3由大到小的排序为______________________________。
②在T2、60MPa条件下,比较A点v正___v逆(填“>”、“<”或“=”),理由是____________。
③计算T2、60Mpa平衡体系的平衡常数Kp=__________。(用平衡分压代替平衡浓度计算,分压=总压x物质的量分数)
【答案】 CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H=+165.4 kJ/mol CH4 10CH4+8H2O+O2=10CO+28H2 D T3>T2>T1 > 在T2、60Mpa 时A点未达到平衡时的体积分数,反应向正向进行,所以v(正)>v(逆) 0.043(MPa)-2或 0.0427(MPa)-2
【解析】(1)根据图像得到热化学方程式Ⅰ.CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.4kJ/mol,Ⅱ.CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.0kJ/mol,结合盖斯定律计算Ⅰ+Ⅱ得到1mol CH4(g)通过蒸汽转化为CO2(g)和H2(g)的热化学方程式:CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+165.4 kJ/mol,故答案为:CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+165.4kJ/mol;
(2)①甲烷中C失去电子生成CO,则起还原作用的物质是CH4,故答案为:CH4;
②空气中N2与O2的物质的量之比为4:1,膜Ⅰ侧所得气体![]() =2,氮气在反应前后不变,设氮气为4mol,则生成氢气为8mol,膜Ⅰ侧发生的电极反应式是H2O+2e-=H2+O2-、O2+4e-=2O2-,由膜I侧反应可知8molH2O得到16mol电子、1molO2得到4mol电子,共得到20mol电子,膜II上1molCH4中C失去6mol电子、H得到4mol电子,即1molCH4失去2mol电子,根据总反应遵循电子守恒,需要10molCH4反应,则反应为10CH4+8H2O+O2=10CO+28H2,故答案为:10CH4+8H2O+O2=10CO+28H2;
=2,氮气在反应前后不变,设氮气为4mol,则生成氢气为8mol,膜Ⅰ侧发生的电极反应式是H2O+2e-=H2+O2-、O2+4e-=2O2-,由膜I侧反应可知8molH2O得到16mol电子、1molO2得到4mol电子,共得到20mol电子,膜II上1molCH4中C失去6mol电子、H得到4mol电子,即1molCH4失去2mol电子,根据总反应遵循电子守恒,需要10molCH4反应,则反应为10CH4+8H2O+O2=10CO+28H2,故答案为:10CH4+8H2O+O2=10CO+28H2;
(3)A、由图象分析可知,平衡常数是温度的函数,温度不变平衡常数不变,故A错误;B、t2时刻改变条件后达到平衡时,逆反应速率增大,不能说明平衡移动的方向,无法判断氨气体积分数的变化,故B错误;C、容器的体积不变,气体的质量不变,气体的密度始终不变,不能用于平衡的判断,故C错误;D、t2时刻,向密闭容器中加H2和N2混合气,气体的压强增大,逆反应速率增大,故D正确;故选D;
(4)①N2(g)+3H2(g)![]() 2NH3(g) ΔH< 0,相同压强下,升高温度平衡逆向移动,氨气的体积分数减小,根据图知,温度由大到小的顺序为T3>T2>T1,故答案为:T3>T2>T1;
2NH3(g) ΔH< 0,相同压强下,升高温度平衡逆向移动,氨气的体积分数减小,根据图知,温度由大到小的顺序为T3>T2>T1,故答案为:T3>T2>T1;
②根据图像,在T2、60MPa条件下,A点为达到平衡状态,要达到平衡,反应需要继续正向进行,因此v正>v逆,故答案为:>;在 T2、 60Mpa 时A点未达到平衡时的体积分数,反应向正向进行,所以 v(正)>v(逆);
③若体系在T2、60MPa下达到平衡,相同温度下,气体的体积分数等于其物质的量分数,
设平衡时n(NH3)=xmol,
N2(g) + 3H2(g)2NH3(g)
开始(mol) 9 23 0
反应(mol) 0.5x 1.5x x
平衡(mol)9-0.5x 23-1.5x x
平衡时氨气体积分数=![]() ×100%=60%,解得x=12,氮气分压=
×100%=60%,解得x=12,氮气分压=![]() ×60MPa=9MPa;氨气的分压=60%×60MPa=36MPa,氢气分压=60MPa-9MPa-36MPa=15MPa,此时的平衡常数Kp=
×60MPa=9MPa;氨气的分压=60%×60MPa=36MPa,氢气分压=60MPa-9MPa-36MPa=15MPa,此时的平衡常数Kp= =0.043(MPa)-2,故答案为:0.043(MPa)-2。
=0.043(MPa)-2,故答案为:0.043(MPa)-2。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案【题目】25℃时,几种弱酸的电离平衡常数如下:
弱酸 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)CH3COOH、H2CO3、H2SO3三种酸中酸性最弱的是__________(填化学式)。
(2)CH3COOH的电离平衡常数表达式为K=__________。
(3)写出H2CO3的第二步电离方程式:_____________。
(4)写出H2SO3溶液和CH3COONa溶液反应的离子方程式:____________________。
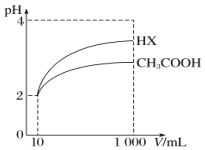
(5)将体积均为10mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH的变化如图所示,则HX的电离平衡常数____________(填“大于”“小于”或“等于”)醋酸的电离平衡常数,理由是__________________。