题目内容
【题目】某校化学研究性学习小组欲设计实验验证Zn、Fe、Cu的金属活动性,他们提出了以下两种方案.请你帮助他们完成有关实验项目:
(1)用三种金属与盐酸反应的现象来判断,实验中除选择大小相同的金属片外,还需要控制________、________相同;若选用一种盐溶液验证三种金属的活泼性,该试剂________.
(2)①若用Zn、Cu作电极设计成原电池,并能产生持续稳定的电流,以确定Zn、Cu的活动性.试在下面方框中画出原电池装置图,标出原电池的电极材料和电解质溶液_______.

②上述装置中正极反应式为 ________.
③某小组同学采用Zn、Fe作为电极,只用一个原电池证明三种金属的活动性,则电解质溶液最好选用________.
A.0.5molL﹣1氯化亚铁溶液
B.0.5molL﹣1氯化铜溶液
C.0.5molL﹣1盐酸
D.0.5molL﹣1氯化亚铁和0.5molL﹣1氯化铜混合溶液
【答案】盐酸的浓度溶液的温度硫酸亚铁溶液(或其他的亚铁盐溶液)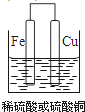 2H++2e﹣=H2↑或Cu2++2e﹣=CuD
2H++2e﹣=H2↑或Cu2++2e﹣=CuD
【解析】
(1)用三种金属与盐酸反应的现象来判断金属的活泼性,实验中除选择大小相同的金属片外,温度、浓度等外界因素应相同,选择盐溶液时利用金属单质之间的置换反应比较金属的活泼性;(2)①原电池中Fe为负极,Cu为正极,则Fe活泼性强,可选硫酸或硫酸铜作电解质;②Al、Fe作为电极,只用一个原电池证明三种金属的活动性,由金属阳离子的得电子能力比较。
(1)用三种金属与盐酸反应的现象来判断金属的活泼性,实验中除选择大小相同的金属片外,温度、浓度等外界因素应相同,则盐酸的浓度、溶液的温度应相同,选择盐溶液时利用金属单质之间的置换反应比较金属的活泼性,则可选择硫酸亚铁溶液(或其他的亚铁盐溶液),Zn可置换出Fe,而Cu不能,以此可知金属活泼性为Zn>Fe>Cu,故答案为:盐酸的浓度;溶液的温度;硫酸亚铁溶液(或其他的亚铁盐溶液);(2)①原电池中Fe为负极,Cu为正极,则Fe活泼性强,可选硫酸或硫酸铜作电解质,原电池装置如图: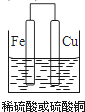 ,正极反应为2H++2e-=H2↑或Cu2++2e-=Cu;②Zn、Fe作为电极,只用一个原电池证明三种金属的活动性,由金属阳离子的得电子能力比较,只有D符合,选D时铜离子先得到电子,然后亚铁离子得电子,由此可确定金属的活泼性,答案选D。
,正极反应为2H++2e-=H2↑或Cu2++2e-=Cu;②Zn、Fe作为电极,只用一个原电池证明三种金属的活动性,由金属阳离子的得电子能力比较,只有D符合,选D时铜离子先得到电子,然后亚铁离子得电子,由此可确定金属的活泼性,答案选D。