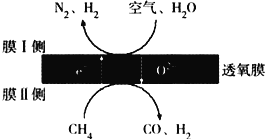
题目内容
【题目】运用树状分类法对下列10种物质进行分类
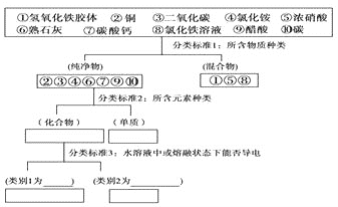
其中,强电解质有:________、弱电解质有:________,写出③的水化物的电离方程式:________.
【答案】 ④、⑥、⑦ ⑨ H2CO3H++HCO3-
【解析】
在水溶液或熔融状态下能导电的化合物是电解质,在水溶液和熔融状态下均不导电的化合物是非电解质;在水溶液中完全电离成离子的电解质属于强电解质,发生部分电离的电解质属于弱电解质,据此分析。
在水溶液或熔融状态下能导电的化合物是电解质,如④、⑥、⑦、⑨,在水溶液中完全电离成离子的电解质属于强电解质,如④、⑥、⑦;在溶液中发生部分电离的电解质属于弱电解质如⑨;③二氧化碳与水反应生成碳酸,碳酸在溶液中发生两步电离,以第一步为主,碳酸的电离方程式为:H2CO3H++HCO3-,
因此,本题正确答案是:④、⑥、⑦;⑨;H2CO3H++HCO3-。

练习册系列答案
相关题目