题目内容
【题目】氨在工农业生产中应用广泛。
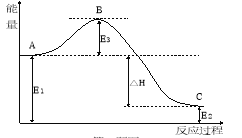
(1)根据下图写出合成氨的热化学方程式是________________________。

(2)将1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量___________(填“大于”、“等于”或“小于”)92.2 kJ,原因是______________;若加入催化剂,ΔH________(填“变大”、“不变”或“变小”)。
(3)已知分别破坏1 mol N≡N键、1 mol H-H键时需要吸收的能量为946 kJ、436 kJ,则破坏1 mol N—H键需要吸收的能量为________kJ。
(4)N2H4可视为NH3分子中的H被-NH2取代的产物。发射卫星时以N2H4(g)为燃料、NO2为氧化剂,二者反应生成N2和H2O(g)。
已知:N2(g)+2O2(g)==2NO2(g) ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)==N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1
则1 mol N2H4与NO2完全反应的热化学方程式为_______________。
【答案】(1)N2(g)+3H2(g)![]() 2NH3(g)△H=-92.2kJ/mol
2NH3(g)△H=-92.2kJ/mol
(2)小于;该反应是可逆反应,反应物无法全部转化为生成物;不变;(3)391
(4)N2H4(g)+NO2(g)=3/2N2(g)+2H2O(g)△H=-567.85 kJmol-1
【解析】
试题分析:(1)由图可知,0.5molN2(g)与1.5molH2(g)完全反应生成1molNH3(g)的反应热为-46.1kJ/mol,所以合成氨的热化学反应方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=-92.2kJ/mol;
2NH3(g)△H=-92.2kJ/mol;
(2)反应是可逆反应,反应物不能完全转化,3mol H2和1mol N2充分参与反应也不可能生成2molNH3,故放出的热量小于92KJ的热量,催化剂改变反应速率不改变化学平衡,反应焓变不变;
(3)已知:分别破坏1mol N≡N键、1mol H-H键需要吸收的能量为:946kJ、436kJ,设破坏1mol N-H键需要吸收的能量为x,N2(g)+3H2(g)![]() 2NH3(g)△H=-92.2kJ/mol,焓变=反应物总键能-生成物的总键能,946kJ/mol+3×436kJ/mol-6x=92.2KJ/mol,x=391KJ/mol,破坏1mol N-H键需要吸收的能量为:391kJ;
2NH3(g)△H=-92.2kJ/mol,焓变=反应物总键能-生成物的总键能,946kJ/mol+3×436kJ/mol-6x=92.2KJ/mol,x=391KJ/mol,破坏1mol N-H键需要吸收的能量为:391kJ;
(4):①N2(g)+O2(g)=2NO2(g)△H1=+67.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ/mol
依据盖斯定律:②×2-①得到:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJ/mol,1mol
N2H4与NO2完全反应的热化学方程式为:N2H4(g)+NO2(g)=3/2N2(g)+2H2O(g)△H=-567.85 kJmol-1。

 阅读快车系列答案
阅读快车系列答案【题目】一个化学反应,我们不但要关心物质变化,还要研究能量变化和反应快慢。
(1)下面是一个由天然气和水反应制备氢气的反应,其方程式为:CH4(g)+ 2H2O(g) ![]() CO2(g)+4H2(g)该反应过程中能量变化如图所示,则该反应为______反应(填“吸热”或“放热”),
CO2(g)+4H2(g)该反应过程中能量变化如图所示,则该反应为______反应(填“吸热”或“放热”),
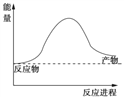
若已知,破坏1mol化学键需要吸收的热量如下表所示:则该反应吸收或放出热量为______kJ (用含a b c d字母的代数式表示)。
化学键 | C—H | O—H | C=O | H—H |
吸收热量(kJ/mol) | a | b | c | d |
(2)一定温度下,将3 molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为________;X为__________。若反应经2min达到平衡,平衡时C的浓度______0.8mol/L(填“大于”,“小于”或“等于”)。若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为__________。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为________;X为__________。若反应经2min达到平衡,平衡时C的浓度______0.8mol/L(填“大于”,“小于”或“等于”)。若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为__________。