题目内容
【题目】实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)煤化工通常通过研究不同温度下的平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:
CO(g)+H2O(g)![]() H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
①若在500℃时进行反应,设CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为 。
②800℃时,在固定容积的密闭容器中放入混合物,起始浓度为:c(CO)=0.01mol/L,c(H2O)=0.03mol/L,c(CO2)=0.01mol/L, c(H2)=0.05mol/L ,则反应开始时,H2的消耗速率比生成速率 (填“大”、“小”或“不能确定”)。
(2)2SO2(g)+O2(g)![]() 2SO3(g)反应过程中的能量变化如图所示:又已知1molSO2(g)氧化为1molSO3(g)的ΔH=-99 kJ·mol-1,请回答问题:
2SO3(g)反应过程中的能量变化如图所示:又已知1molSO2(g)氧化为1molSO3(g)的ΔH=-99 kJ·mol-1,请回答问题:
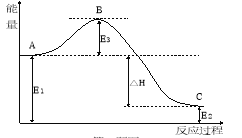
该反应通常用V2O5作催化剂,加V2O5会使图中B点 (填“升高”或“降低” )△H (填“变大”、“变小”或“不变”);
(3)已知某反应的平衡常数表达式为:![]() ,它所对应反应的化学方程式为
,它所对应反应的化学方程式为
【答案】(10分每空2分)
(1)①、75%、②大(2)降低;不变
(3)C(s)+H20(g)![]() H2(g)+CO(g)
H2(g)+CO(g)
【解析】
试题分析:(1)③若在500℃时进行,平衡常数K=9,设CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为,设一氧化碳消耗物质的量浓度为x,
CO(g)+H2O(g)H2(g)+CO2(g)
起始量(mol/L) 0.02 0.02 0 0
变化量(mol/L) x x x x
平衡量(mol/L) 0.02-x 0.02-x x x
![]() =9,x=0.015mol/L,一氧化碳的转化率=0.015mol/L÷0.02mol/L×100%=75%;
=9,x=0.015mol/L,一氧化碳的转化率=0.015mol/L÷0.02mol/L×100%=75%;
④800℃时,K=1,在固定容积的密闭容器中放入混合物,起始浓度为:c(CO)=0.01mol/L,c(H2O)=0.03mol/L,c(CO2)=0.01mol/L,c(H2)=0.05mol/L,Qc=![]() >K=1,反应逆向进行,则反应开始时,H2O的消耗速率比生成速率小;
>K=1,反应逆向进行,则反应开始时,H2O的消耗速率比生成速率小;
(2)反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关,加入催化剂,活化能减小,反应反应热不变,该反应通常用V2O5作催化剂,加V2O5会使图中B点降低;
(3)已知某反应的平衡常数表达式为![]() ,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,反应前后元素守恒得到化学方程式为:C(s)+H2O(g)═CO(g)+H2(g)。
,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,反应前后元素守恒得到化学方程式为:C(s)+H2O(g)═CO(g)+H2(g)。

 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】有些中国古文或谚语包含了丰富的化学知识,下列解释不合理的是
选项 | 古文或谚语 | 化学解释 |
A | 粉身碎骨浑不怕,要留清白在人间 | 发生了化学变化 |
B | 以曾青涂铁,铁赤色如铜 | 化合反应 |
C | 煮豆燃豆箕 | 化学能转化为热能 |
D | 雷雨肥庄稼 | 自然固氮 |
A. A B. B C. C D. D