题目内容
【题目】A、B、C和D是同一周期的四种元素,A、B、C的原子序数依次相差1;A元素的单质化学性质最活泼,能与水直接发生反应.B元素的氧化物2.0g恰好跟100mL0.5mol/L的H2SO4完全反应.B元素的单质跟D元素单质反应生成BD2型化合物.根据以上事实回答:
(1)A原子的结构示意图为
(2)C在周期表中的位置:
(3)BD2含有的化学键类型为
(4)A、C两元素最高价氧化物的水化物相互反应的离子方程式为 .
【答案】(1)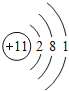 ;
;
(2)
第三周期ⅢA族;
(3)离子键;
(4)Al(OH)3+OH﹣═AlO2﹣+2H2O.
【解析】试题分析:A、B、C、D是同一周期的四种元素,A元素的单质化学性质活泼、能与水直接发生反应,则A处于ⅠA族;
A、B、C的原子序数依次相差为1,则B处于ⅡA族、C处于ⅢA族;
B的氧化物为BO,氧化物BO的物质的量等于硫酸的物质的量=0.1L×0.5mol/L=0.05mol,BO的相对分子质量为:![]() =40g/mol,则B的相对原子质量为:40﹣16=24,则B为Mg元素、故A为Na、C为Al;
=40g/mol,则B的相对原子质量为:40﹣16=24,则B为Mg元素、故A为Na、C为Al;
B元素的单质跟D元素单质反应生成化合物BD2,B为+2价,则D为﹣1价,所以D为Cl元素,结合题目分析解答.
解:、B、C、D是同一周期的四种元素,A元素的单质化学性质活泼、能与水直接发生反应,则A处于ⅠA族;
A、B、C的原子序数依次相差为1,则B处于ⅡA族、C处于ⅢA族;
B的氧化物为BO,氧化物BO的物质的量等于硫酸的物质的量=0.1L×0.5mol/L=0.05mol,BO的相对分子质量为:![]() =40g/mol,则B的相对原子质量为:40﹣16=24,则B为Mg元素、故A为Na、C为Al;
=40g/mol,则B的相对原子质量为:40﹣16=24,则B为Mg元素、故A为Na、C为Al;
B元素的单质跟D元素单质反应生成化合物BD2,B为+2价,则D为﹣1价,所以D为Cl元素,
(1)A为Na,其原子序数为11,最外层含有1个电子,Na的原子结构为: ,故答案为:
,故答案为: ;
;
(2)C是Al元素,其原子核外有3个电子层、最外层电子数是3,所以C位于第三周期第IIIA族,
故答案为:第三周期ⅢA族;
(3)MgCl2中镁离子和氯离子只存在离子键,故答案为:离子键;
(4)A、C两元素最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠和水,反应的离子方程式为:Al(OH)3+OH﹣═AlO2﹣+2H2O,
故答案为:Al(OH)3+OH﹣═AlO2﹣+2H2O.

 名校课堂系列答案
名校课堂系列答案