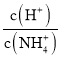题目内容
【题目】常温下,用0.1mol/L的盐酸滴定0.1mol/L的Na2CO3溶液25mL。测得溶液pH变化曲线如图,下列说法正确的是( )

A. b点时,c(CO32-)>c(HCO3-)>c(OH-)
B. d点时,c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
C. e点时,c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
D. c→d发生的主要离子反应:H++HCO3-=CO2↑+H2O
【答案】C
【解析】A,b点加入12.5mL的盐酸,得到等物质的量浓度的NaHCO3、Na2CO3和NaCl的混合液,由于CO32-的水解能力大于HCO3-的水解能力,则c(HCO3-)![]() c(CO32-)
c(CO32-)![]() c(OH-),A项错误;B,d点加入25mL的盐酸,得到等物质的量浓度的NaHCO3和NaCl的混合液,溶液中的电荷守恒为c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),溶液中的物料守恒为c(Na+)=2[c(HCO3-)+c(H2CO3)+c(CO32-)]=2c(Cl-),两式整理得c(H+)+c(H2CO3)=c(OH-)+c(CO32-),B项错误;C,e点加入50mL盐酸,得到NaCl和H2CO3的混合液,溶液中的电荷守恒为c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),NaCl属于强酸强碱盐,c(Na+)=c(Cl-),则c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),C项正确;D,c→d发生的主要离子反应为CO32-+H+=HCO3-,D项错误;答案选C。
c(OH-),A项错误;B,d点加入25mL的盐酸,得到等物质的量浓度的NaHCO3和NaCl的混合液,溶液中的电荷守恒为c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),溶液中的物料守恒为c(Na+)=2[c(HCO3-)+c(H2CO3)+c(CO32-)]=2c(Cl-),两式整理得c(H+)+c(H2CO3)=c(OH-)+c(CO32-),B项错误;C,e点加入50mL盐酸,得到NaCl和H2CO3的混合液,溶液中的电荷守恒为c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),NaCl属于强酸强碱盐,c(Na+)=c(Cl-),则c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),C项正确;D,c→d发生的主要离子反应为CO32-+H+=HCO3-,D项错误;答案选C。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】
(1)在图所示仪器中,配制上述溶液肯定不需要的是______(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是______.
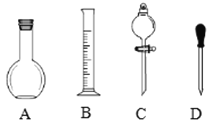
(2)在容量瓶的使用方法中,下列操作不正确的是______
A.使用容量瓶前检验是否漏水 |
B.容量瓶用水洗净后,再用待配溶液洗涤 |
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线. |
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线. |
E.盖好瓶塞,用食指顶住瓶塞,另一只手的手指托住瓶底,把容量瓶反复倒转多次,摇匀.
(3)根据计算用托盘天平称取NaOH固体的质量为______g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度______0.1mol/L(填“大于”“小于”或“等于”).
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为______mL,如果实验室有15mL、20mL、50mL量筒,应选用______mL量筒最好.