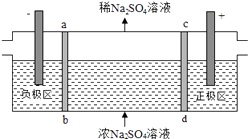
��Ŀ����
����Ŀ�������Dz��ֶ������еڶ�����������Ԫ�ص�ԭ�Ӱ뾶����Ҫ���ϼۡ�
Ԫ�ش��� | �� | �� | �� | �� | �� | �� | �� | �� |
ԭ�Ӱ뾶��nm�� | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
��Ҫ���ϼ� | ��1 | ��2 | ��1 | ��3 | ��5����3 | ��7����1 | ��5����3 | ��2 |
�ش��������⣺
��1������Ԫ�����ڱ��е�λ���ǣ����ڡ��壩��
��2��8��Ԫ�ص�����������ˮ�����У�������ǿ�������ѧʽ����
��3��Ԫ�آݡ��ߡ���ֱ��γɵļ���̬�⻯���У��ߵĵ���ʽΪ �� �ȶ�����ǿ���⻯��ĽṹʽΪ��
��4��д���١��ܵ�����������Ӧ��ˮ����֮�䷢����Ӧ�����ӷ���ʽ��
��5���õ���ʽ��ʾԪ�آ�����γɻ�����Ĺ�����
���𰸡�
��1���ڶ����ڵڢ�A��
��2��HClO4
��3��![]() ,H��O��H
,H��O��H
��4��Al��OH��3 + OH-=AlO2--+ 2H2O
��5��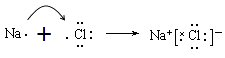
���������⣺����Ԫ��ԭ�Ӱ뾶����Ҫ���ϼۿ�֪���١���Ԫ�طֱ���Na��Mg��Li��Al��P��Cl��N��O����1����Ԫ����Ԫ�����ڱ��е�λ���ǵڶ����ڵڢ�A�塣��2���ǽ�����Խǿ������������ˮ���������Խǿ��������8��Ԫ�ص�����������ˮ�����У�������ǿ����HClO4����3��Ԫ�آݡ��ߡ���ֱ��γɵļ���̬�⻯���У����ǰ���������ʽΪ ![]() ���ǽ�����Խǿ���⻯��Խ�ȶ���Ԫ�آݡ��ߡ�������Ԫ�طǽ�������ǿ�����ȶ�����ǿ���⻯����ˮ���ṹʽΪH��O��H����4���١��ܵ�����������Ӧ��ˮ����ֱ����������ƺ���������������֮�䷢����Ӧ�����ӷ���ʽΪAl��OH��3 + OH-= AlO2--+ 2H2O����5��Ԫ�آ�����γɻ����������ӻ������Ȼ��ƣ����γɹ��̿ɱ�ʾΪ
���ǽ�����Խǿ���⻯��Խ�ȶ���Ԫ�آݡ��ߡ�������Ԫ�طǽ�������ǿ�����ȶ�����ǿ���⻯����ˮ���ṹʽΪH��O��H����4���١��ܵ�����������Ӧ��ˮ����ֱ����������ƺ���������������֮�䷢����Ӧ�����ӷ���ʽΪAl��OH��3 + OH-= AlO2--+ 2H2O����5��Ԫ�آ�����γɻ����������ӻ������Ȼ��ƣ����γɹ��̿ɱ�ʾΪ 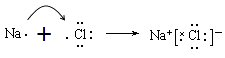 ��
��
���⿼��Ԫ�����ڱ���������ʼ���ع��ɡ�ԭ�Ӱ뾶����Ҫ���ϼ��жϳ�Ԫ�ط��ţ�������ЩԪ�ص���ػ�ѧ������ա�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�