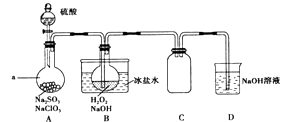
��Ŀ����
����Ŀ���������ƣ�NaNO2����һ�ֳ�����ʳƷ���Ӽ���ʹ��ʱ�����ϸ������������ij��ȤС������ͼ��ʾװ���Ʊ�NaNO2����������������̽����A�м���װ������ȥ���� 
��֪����2NO+Na2O2�T2NaNO2��
��NO�ܱ�����KMnO4������NO3�� �� MnO4������ԭΪMn2+ ��
��1���Ʊ�NaNO2
��i��װ��A������ƿ�з�����Ӧ�Ļ�ѧ����ʽΪ ��
��ii��Bװ�õ�Ŀ���� ��
��iii��Ϊ��֤�Ƶõ��������ƵĴ��ȣ�Cװ����ʢ�ŵ��Լ�������������ţ���
A��P2O5 B����ʯ�� C����ˮCaCl2 D����ʯ��
��iv��Eװ�÷�����Ӧ�����ӷ���ʽ�� ��
��2���ⶨNaNO2����
ȷ��ȡ����Ϊm g��NaNO2��Ʒ������ƿ�У�������ˮ�ܽ⣮��a molL��1����KMnO4��Һ�ζ�����ζ��յ�ʱ����KMnO4��Һ���Ϊbml������Ʒ��NaNO2����������Ϊ ��
��������Ʒ����������������KMnO4��Һ����Ӧ���ú�m��a��b�Ĵ���ʽ��ʾ����
���𰸡�
��1��C+4HNO3��Ũ�� ![]() CO2��+4NO2��+2H2O����NO2ת��ΪNO��ͭ��ϡ���ᷴӦ����NO��BD��5NO+3MnO4��+4H+=5NO3��+3 Mn2++2H20
CO2��+4NO2��+2H2O����NO2ת��ΪNO��ͭ��ϡ���ᷴӦ����NO��BD��5NO+3MnO4��+4H+=5NO3��+3 Mn2++2H20
��2��![]()
���������⣺��1����i��װ��A������ƿ�з�����Ӧ�Ļ�ѧ����ʽΪC+4HNO3��Ũ�� ![]() CO2��+4NO2��+2H2O�����Դ��ǣ�C+4HNO3��Ũ��
CO2��+4NO2��+2H2O�����Դ��ǣ�C+4HNO3��Ũ�� ![]() CO2��+4NO2��+2H2O����ii��Bװ�õ�Ŀ���Ǣٽ�NO2ת��ΪNO����ͭ��ϡ���ᷴӦ����NO�����Դ��ǣ���NO2ת��ΪNO��ͭ��ϡ���ᷴӦ����NO����iii��A��C���������ᣬB��D���������Ҹ������壬���Դ��ǣ�BD����iv������Ϣ��֪��Eװ�õ����������ø��������Һ��ǿ���������������ж�����һ�������������ж���NO���壬������Ⱦ��������Ӧ�����ӷ���ʽΪ��5NO+3MnO4��+4H+=5NO3��+3 Mn2++2H20�����Դ��ǣ�5NO+3MnO4��+4H+=5NO3��+3 Mn2++2H20����2����NaNO2�μӵ����Ը��������Һ�У��ɹ۲쵽��ɫ��Һ��ɫ��dz��ֱ����ɫ��˵�����߷���������ԭ��Ӧ������������ӱ�����������������ӣ�����������ӱ���ԭ���������ӣ���NaNO2�μӵ����Ը��������Һ�У��ɹ۲쵽��ɫ��Һ��ɫ��dz��ֱ����ɫ��˵�����߷���������ԭ��Ӧ������������ӱ�����������������ӣ�����������ӱ���ԭ���������ӣ����ӷ���ʽΪ��ȷ��ȡ����Ϊm g��NaNO2��Ʒ������ƿ�У�������ˮ�ܽ⣮��a molL��1����KMnO4��Һ�ζ�����ζ��յ�ʱ����KMnO4��Һ���Ϊbml��
CO2��+4NO2��+2H2O����ii��Bװ�õ�Ŀ���Ǣٽ�NO2ת��ΪNO����ͭ��ϡ���ᷴӦ����NO�����Դ��ǣ���NO2ת��ΪNO��ͭ��ϡ���ᷴӦ����NO����iii��A��C���������ᣬB��D���������Ҹ������壬���Դ��ǣ�BD����iv������Ϣ��֪��Eװ�õ����������ø��������Һ��ǿ���������������ж�����һ�������������ж���NO���壬������Ⱦ��������Ӧ�����ӷ���ʽΪ��5NO+3MnO4��+4H+=5NO3��+3 Mn2++2H20�����Դ��ǣ�5NO+3MnO4��+4H+=5NO3��+3 Mn2++2H20����2����NaNO2�μӵ����Ը��������Һ�У��ɹ۲쵽��ɫ��Һ��ɫ��dz��ֱ����ɫ��˵�����߷���������ԭ��Ӧ������������ӱ�����������������ӣ�����������ӱ���ԭ���������ӣ���NaNO2�μӵ����Ը��������Һ�У��ɹ۲쵽��ɫ��Һ��ɫ��dz��ֱ����ɫ��˵�����߷���������ԭ��Ӧ������������ӱ�����������������ӣ�����������ӱ���ԭ���������ӣ����ӷ���ʽΪ��ȷ��ȡ����Ϊm g��NaNO2��Ʒ������ƿ�У�������ˮ�ܽ⣮��a molL��1����KMnO4��Һ�ζ�����ζ��յ�ʱ����KMnO4��Һ���Ϊbml��
2MnO4��+ | 5NO2��+ | 6H+ | = | 2Mn 2++ | 3H2O+ | 5NO3�� |
2 | 5 | |||||
amol/L��b��10��3L | n |
n= ![]() mol
mol
����Ʒ��NaNO2����������Ϊ ![]() ��100%=
��100%= ![]() ��
��
���Դ��ǣ� ![]() ��
��

����Ŀ�������Dz��ֶ������еڶ�����������Ԫ�ص�ԭ�Ӱ뾶����Ҫ���ϼۡ�
Ԫ�ش��� | �� | �� | �� | �� | �� | �� | �� | �� |
ԭ�Ӱ뾶��nm�� | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
��Ҫ���ϼ� | ��1 | ��2 | ��1 | ��3 | ��5����3 | ��7����1 | ��5����3 | ��2 |
�ش��������⣺
��1������Ԫ�����ڱ��е�λ���ǣ����ڡ��壩��
��2��8��Ԫ�ص�����������ˮ�����У�������ǿ�������ѧʽ����
��3��Ԫ�آݡ��ߡ���ֱ��γɵļ���̬�⻯���У��ߵĵ���ʽΪ �� �ȶ�����ǿ���⻯��ĽṹʽΪ��
��4��д���١��ܵ�����������Ӧ��ˮ����֮�䷢����Ӧ�����ӷ���ʽ��
��5���õ���ʽ��ʾԪ�آ�����γɻ�����Ĺ�����