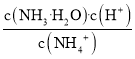题目内容
【题目】氮、磷、砷同为VA族元素,它们的单质和化合物在生产、生活中有广泛应用。回答下列问题:
(1)下列有关氮原子电子排布图中,能量最低和最高的分别为____、___。
a.![]() b.
b.![]()
c.![]() d.
d.![]()
(2)![]() 是一种芳环硝化中间体,其中氮原子的杂化轨道类型为____,与
是一种芳环硝化中间体,其中氮原子的杂化轨道类型为____,与![]() 互为等电子体的化合物分子是___(任写一种,填化学式)。
互为等电子体的化合物分子是___(任写一种,填化学式)。
(3)C、N、O是第二周期相邻的三种非金属元素,它们的第一电离能由大到小的顺序为____;NH3是一种极易溶于水的气体,其沸点比AsH3的沸点______(填“低”或“高”),其原因是______。
(4)砷是制造新型半导体的材料,同时砷的化合物又具有较强的毒性。
1918年美国人通过反应:HC≡CH+AsCl3![]() CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为___;AsCl3分子的空间构型为_____。
CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为___;AsCl3分子的空间构型为_____。
(5)2018年7月《Science》报道,BingLv等通过反应:4BI3+As4![]() 4BAs+6I2合成了具有极高导热性的半导体新材料BAs。BAs晶胞结构如图所示:
4BAs+6I2合成了具有极高导热性的半导体新材料BAs。BAs晶胞结构如图所示:
已知该晶胞参数为a pm,NA表示阿伏加德罗常数,则该晶胞的密度ρ=_____g·cm3(用代数式表示,可不必化简)。
【答案】a c sp CO2(或N2O、CS2等) N>O>C 高 NH3分子间形成氢键,使NH3的沸点反常偏高 3∶2 三角锥形 ![]()
【解析】
根据核外电子排布规律判断微粒能量的大小;根据杂化轨道理论及等电子体理论分析轨道杂化类型及分子的空间构型;根据元素性质及核外电子排布规律比较元素第一电离能;根据晶胞结构及题干信息进行相关计算。
(1)氮原子核外有7个电子,a项电子排布能量最低;b项电子排布违背洪特规则;c项中1s能级上电子发生跃迁,能量最高;d项中电子排布违背洪特规则。
故答案为a;c ;
(2)NO2+的结构类似CO2,都是直线型结构,氮原子通过两个双键与两个O原子相连,氮原子为sp杂化。与NO2+互为等电子体的化合物有:CO2、CS2或N2O等。
故答案为 sp ; CO2(或N2O、CS2等);
(3)氮原子由于2p轨道处于半充满状态,第一电离能反常偏大,故C、N、O三者的第一电离能由大到小的顺序为:N>O>C;氮的电负性强,NH3分子之间形成氢键,使其沸点反常偏高;砷的电负性弱,在AsH3分子间不能形成氢键,因而AsH3的沸点低。
故答案为N>O>C;高;NH3分子间形成氢键,使NH3的沸点反常偏高;
(4)在乙炔分子C≡C中含1个σ键2个π键,此外CH间还有2个σ键,故σ键与π键数目之比3∶2;AsCl3分子类似NH3的结构,As采取sp3杂化,故分子结构为三角锥形。
故答案为3∶2;三角锥形;
(5)在BAs晶胞中B位于顶点和面心,故1个晶胞中含B的个数=8×![]() +6×
+6×![]() =4,As位于晶胞内部有4个,故1个晶胞中含4个BAs;则晶胞质量m=ρ·(a×1010)3=
=4,As位于晶胞内部有4个,故1个晶胞中含4个BAs;则晶胞质量m=ρ·(a×1010)3=![]() ×(11+75) g,故晶胞的密度ρ=
×(11+75) g,故晶胞的密度ρ=![]() g·cm3。
g·cm3。
故答案为 ![]() 。
。

【题目】“绿水青山就是金山银山”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。
已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq) = NH4HSO3(aq) ΔH1=a kJ·mol-1;
②NH3·H2O(aq)+NH4HSO3(aq) = (NH4)2SO3(aq)+H2O(l)ΔH2=b kJ·mol-1;
③2(NH4)2SO3(aq)+O2(g) = 2(NH4)2SO4(aq) ΔH3=c kJ·kJ·mol-1。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l) 的ΔH=________kJ·mol-1
(2)燃煤发电厂常利用反应:2CaCO3(s)+2SO2(g)+O2(g) = 2CaSO4(s)+2CO2(g) ΔH=-681.8 kJ·mol-1对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
0 | 10 | 20 | 30 | 40 | 50 | |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(O2)=________mol·L-1·min-1;当升高温度,该反应的平衡常数K________(填“增大”“减小”或“不变”)。
②30in后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是________(填字母)。
A.加入一定量的粉状碳酸钙 B.通入一定量的O2
C.适当缩小容器的体积 D.加入合适的催化剂
(3)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g)N2(g)+CO2(g) ΔH=-34.0 kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压,测得NO的转化率随温度的变化如图所示:
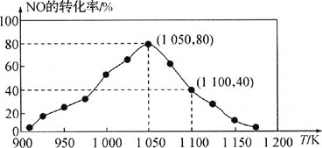
由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因为________;在1100K时,CO2的体积分数为________。
(4)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=________[已知:气体分压(P分)=气体总压(P总)×体积分数]。
(5)工业上常用高浓度的 K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图:
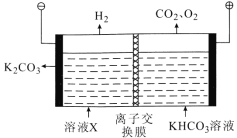
①在阳极区发生的反应包括___________和H++HCO3- =CO2↑+H2O
②简述CO32-在阴极区再生的原理:______________。
【题目】环乙烯是一种重要的化工原料,实验室常用下列反应制备环乙烯:

环己醇、环己烯的部分物理性质见下表:
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.9624 | 能溶于水 |
环己烯 | 83(70.8)* | 0.8085 | 不溶于水 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物中有机物的质量分数
Ⅰ:制备环己烯粗品。实验中将环己醇与浓硫酸混合加入烧瓶中,按图所示装置,油浴加热,蒸馏约1h,收集馏分,得到主要含环己烯和水的混合物。

Ⅱ:环己烯的提纯。主要操作有;
a.向馏出液中加入精盐至饱和;
b.加入3~4mL5%Na2CO3溶液;
c.静置,分液;
d.加入无水CaCl2固体;
e.蒸馏
回答下列问题:
(1)油浴加热过程中,温度控制在90℃以下,蒸馏温度不宜过高的原因是________。
(2)蒸馏不能彻底分离环己烯和水的原因是_______________。
(3)加入精盐至饱和的目的是_____________________。
(4)加入3~4mL5%Na2CO3溶液的作用是__________。
(5)加入无水CaCl2固体的作用是______________。
(6)利用核磁共振氢谱可以鉴定制备的产物是否为环己烯,环己烯分子中有_______种不同环境的氢原子。