��Ŀ����
SO2��������������Ҫ�м���Ҳ�ǿ�����Ⱦ����Ҫԭ��֮һ������������SO3�ķ�ӦΪ�� 2SO2��g����O2��g������֪������Ӧ�Ƿ��ȷ�Ӧ�����÷�Ӧ����ƽ��״̬ʱ�����������������£����д�ʩ�����������SO2ƽ��ת���ʵ��� ������ĸ��
��A�������¶� ��B�������¶� ��C������ѹǿ
��D����Сѹǿ ��E��������� ��G���Ƴ����� ����2SO2��g����O2��g��2SO3��g�������ȣ���197kJ��mol��1�����мס��ҡ���������ͬ���ݻ���������������±������ݳ������岢��Ӧ�ﵽƽ�⣬�ų������յ���������ֵ�ֱ�ΪQ1��Q2��Q3������˵���в���ȷ���� ��| ���� | SO2��mol�� | O2��mol�� | SO3��mol�� | ������kJ�� |
| �� | 2 | 1 | 0 | Q1 |
| �� | 1 | 0��5 | 0 | Q2 |
| �� | 0 | 0 | 1 | Q3 |
D��2Q1���� 2Q2 < Q3 < 197kJ
�Ȱ�ˮ���չ�ҵ������β���е�SO2�Ļ�ѧ��ӦΪ��
���д�ʩ�������ȼú������ȥ���ʵ��� ������ĸ����
A������ˮŨ�� B�����߷�Ӧ�¶�
C��ʹȼú�����백ˮ��ֽӴ� D��ͨ�����ʹHSO3��ת��ΪSO42��
��AD��2�֣�
��AC��2�֣�
����:��

ijС��ͬѧ���Ʊ�SO2��̽�������ʣ�
��һ��ʵ��������ҪSO2����22��4 L����״���������ݻ�ѧ����ʽZn + 2 H2SO4��Ũ��![]() ZnSO4 + SO2�� + 2 H2O�����ȡ65.0 gп����98%��ŨH2SO4���ѣ�1.84 g/mL��110 mL��ַ�Ӧ��пȫ���ܽ⡣�����Ƶõ����壬��ͬѧ��Ϊ���ܻ������ʡ�
ZnSO4 + SO2�� + 2 H2O�����ȡ65.0 gп����98%��ŨH2SO4���ѣ�1.84 g/mL��110 mL��ַ�Ӧ��пȫ���ܽ⡣�����Ƶõ����壬��ͬѧ��Ϊ���ܻ������ʡ�
��1�����Ƶõ������л��е�������������� �������ʽ���������������ʵ���Ҫԭ���� ���û�ѧ����ʽ�����
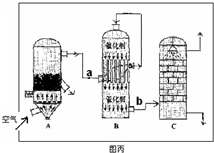
��2��Ϊ֤ʵ��ط�������װ������װ�ã�������ȡ���������̽����
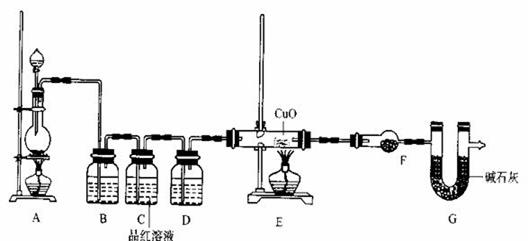
��װ��B�м�����Լ��� �������� ��
��װ��D�м�����Լ��� ��װ��F�м�����Լ� �� ��
�ۿ�֤ʵһ������п����һ������Ũ���ᷴӦ�����ɵ������л��и����������ʵ�������� ��
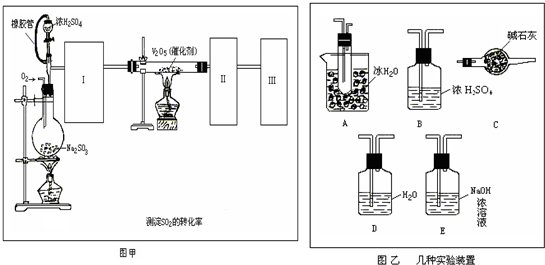
������������ͼ��ʾ��װ��̽��S![]() O2�����ʣ�
O2�����ʣ�
��֪���۵�![]() ��SO2 �� 76.1�棬SO3 16.8�棻�е㣺SO2 �� 10�棬SO3 45��
��SO2 �� 76.1�棬SO3 16.8�棻�е㣺SO2 �� 10�棬SO3 45��
| |
|
|
��1��װ��Iģ�ҵ����SO3�ķ�Ӧ���仯ѧ����ʽ�� ��
��2����ͬѧ��I��II��III��IV��˳������װ�ã�װ��II��������
��װ��III����Һ![]() ����ɫ����Mn2+���ɣ�ͬʱ��Һ����
����ɫ����Mn2+���ɣ�ͬʱ��Һ����![]() ��ǿ����÷�Ӧ�����ӷ���ʽ�� ��
��ǿ����÷�Ӧ�����ӷ���ʽ�� ��
��3����ͬѧ��I��II��IV��˳������װ�ã���װ��IV����40 mL 2.5 mol??L��1 NaOH��Һ����Ӧ����Һ���� 4.8 g����Ӧ����Һ�к��е�������
���ѧʽ������Ӧ�������ʵ���֮��Ϊ ��