题目内容
某小组同学欲制备SO2并探究其性质:
(一)实验室中需要SO2气体22.4 L(标准状况)。依据化学方程式Zn + 2 H2SO4(浓)![]() ZnSO4 + SO2↑ + 2 H2O计算后,取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g/mL)110 mL充分反应,锌全部溶解。对于制得的气体,有同学认为可能混有杂质。
ZnSO4 + SO2↑ + 2 H2O计算后,取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g/mL)110 mL充分反应,锌全部溶解。对于制得的气体,有同学认为可能混有杂质。
(1)所制得的气体中混有的杂质气体可能是 (填分子式)。产生这种杂质的主要原因是 (用化学方程式表达)。
(2)为证实相关分析,组装了如下装置,对所制取的气体进行探究。
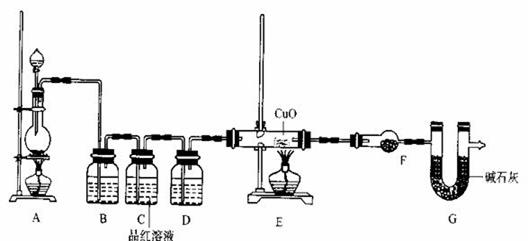
①装置B中加入的试剂是 ,作用是 。
②装置D中加入的试剂是 ,装置F中加入的试剂 是 。
③可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有该杂质气体的实验现象是 。
(二)利用下图所示的装置探究S![]() O2的性质:
O2的性质:
已知:熔点![]() :SO2 - 76.1℃,SO3 16.8℃;沸点:SO2 - 10℃,SO3 45℃
:SO2 - 76.1℃,SO3 16.8℃;沸点:SO2 - 10℃,SO3 45℃
| |
|
|
(1)装置I模拟工业生产SO3的反应,其化学方程式是 。
(2)甲同学按I、II、III、IV的顺序连接装置,装置II的作用是
;装置III中溶液![]() 逐渐褪色,有Mn2+生成,同时溶液酸性
逐渐褪色,有Mn2+生成,同时溶液酸性![]() 增强,则该反应的离子方程式是 。
增强,则该反应的离子方程式是 。
(3)乙同学按I、II、IV的顺序连接装置,若装置IV中有40 mL 2.5 mol??L-1 NaOH溶液,反应后溶液增重 4.8 g,则反应后溶液中含有的溶质有
(填化学式),对应溶质物质的量之比为 。
(24分)
(一)(1)H2(1分); Zn + H2SO4 === ZnSO4 + H2↑(3分)
(2)①NaOH溶液(或KMnO4溶液)(1分);
除去混合气体中的SO2(2分)
②浓硫酸(1分);无水硫酸铜(1分)
③E玻璃管黑色CuO粉末变为红色,F中无水硫酸铜变为蓝色(3分)
(二)(1)2 SO2 + O2 ![]() 2 SO3 (3分)
2 SO3 (3分)
(2)使SO3凝结成固体与SO2分离(2分);
5SO2 + 2H2O + 2MnO4-= 5SO42-+ 2Mn2+ + 4H+(3分)
(3) Na2SO3﹑ NaHSO3 (2分); 1:2(2分)

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案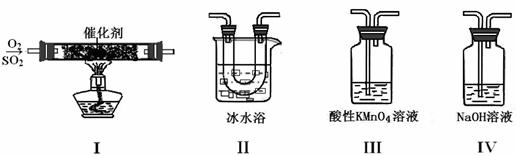
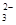 ,可能含有CO
,可能含有CO
 的离子方程式为_____________________________________;
的离子方程式为_____________________________________;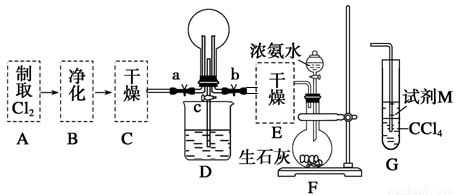
 ,可能含有CO
,可能含有CO
 的离子方程式为_____________________________________;
的离子方程式为_____________________________________;