题目内容
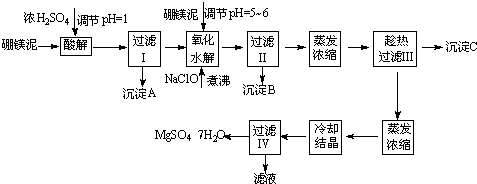
MgSO4?7H2O医药上用作泻剂.工业上用氯碱工业中的一次盐泥为原料生产.已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分.主要工艺如下: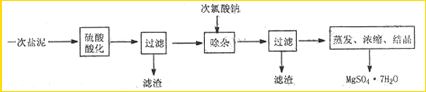
(1)用硫酸调整溶液pH到1~2,硫酸的作用是
(2)加次氯酸钠溶液至pH=5~6并加热煮沸约5~10分钟,滤渣中主要含MnO2和另两种沉淀,另两种沉淀是
(3)若除杂后过滤,发现滤液发黄,需采取的措施是
(4)过滤后晶体常用丙酮代替蒸馏水洗涤的目的是
(5)晶体中结晶水含量的测定:准确称取0.20g MgSO4?7H2O样品,放入已干燥至恒重的瓷坩埚,置于马弗炉中,在200℃脱水1小时.为准确确定脱水后的质量,还需要经过的操作有:冷却(干燥器中)至室温→
(6)硫酸根离子质量分数的测定:准确称取自制的样品0.50g,用200mL水溶液,加入2mol?L-1HCl溶液5mL,将溶液加热至沸,在不断搅拌下逐滴加入5~6mL0.5mol?L-1BaCl2溶液,充分沉淀后,得沉淀0.466g,则样品中w(
| SO | 2- 4 |
分析:(1)将盐泥中的碳酸盐、硅酸盐转化为硫酸盐,硅酸盐转化为硅酸沉淀,钙盐转化为硫酸钙沉淀而除去;
(2)加热煮沸的主要目的是促进Al3+、Fe3+水解及Mn2+氧化成MnO2;
(3)滤液发黄可能含有三价铁离子;
(4)丙酮易挥发;
(5)重复脱水后恒重说明已经完全脱水;
(6)根据硫酸钡的质量求硫酸根的质量;
(2)加热煮沸的主要目的是促进Al3+、Fe3+水解及Mn2+氧化成MnO2;
(3)滤液发黄可能含有三价铁离子;
(4)丙酮易挥发;
(5)重复脱水后恒重说明已经完全脱水;
(6)根据硫酸钡的质量求硫酸根的质量;
解答:解:(1)将盐泥中的碳酸盐、硅酸盐转化为硫酸盐,硅酸盐转化为硅酸(SiOrnH2O)沉淀,钙盐转化为硫酸钙沉淀而除去,故答案为:浸出Mg、Fe、Al、Mn离子,除去Si、Ca;
(2)Al3+、Fe3+水解生成Al(OH)3、Fe(OH)3,NaClO溶液在加热条件下将溶液中的Mn2+氧化成MnO2,反应的离子方程式为Mn2++ClO-+H2O=MnO2↓+2H++Cl-,故答案为:Al(OH)3、Fe(OH)3;Mn2++2OH一+C1O一=MnO2↓+Cl一+H2O;
(3)滤液发黄可能含有三价铁离子,可添加适量的次氯酸钠溶液,次氯酸钠显碱性,可促进三价铁离子的水解,再煮沸、过滤,故答案为:添加适量的次氯酸钠溶液,再煮沸、过滤;
(4)用丙酮代替蒸馏水洗涤可减小硫酸镁的溶解损耗,并快速干燥,故答案为:减小硫酸镁的溶解损耗,并快速干燥;
(5)重复脱水后至恒重说明已经完全脱水,故答案为:称量后重复脱水→冷却→称量至恒重;
(6)m(
)=
×96=0.192g,w(
)=
=38.4%,故答案为:38.4%;
(2)Al3+、Fe3+水解生成Al(OH)3、Fe(OH)3,NaClO溶液在加热条件下将溶液中的Mn2+氧化成MnO2,反应的离子方程式为Mn2++ClO-+H2O=MnO2↓+2H++Cl-,故答案为:Al(OH)3、Fe(OH)3;Mn2++2OH一+C1O一=MnO2↓+Cl一+H2O;
(3)滤液发黄可能含有三价铁离子,可添加适量的次氯酸钠溶液,次氯酸钠显碱性,可促进三价铁离子的水解,再煮沸、过滤,故答案为:添加适量的次氯酸钠溶液,再煮沸、过滤;
(4)用丙酮代替蒸馏水洗涤可减小硫酸镁的溶解损耗,并快速干燥,故答案为:减小硫酸镁的溶解损耗,并快速干燥;
(5)重复脱水后至恒重说明已经完全脱水,故答案为:称量后重复脱水→冷却→称量至恒重;
(6)m(
| SO | 2- 4 |
| 0.466g |
| 233 |
| SO | 2- 4 |
| 0.192g |
| 0.5g |
点评:本题考查物质的制备、除杂,涉及物质的检验以及沉淀的转化等知识,题目较为综合,有一定难度,考查学生的分析能力.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目