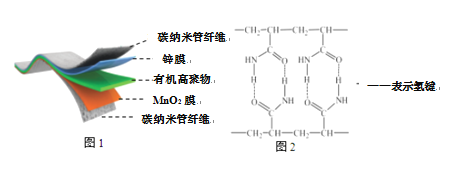
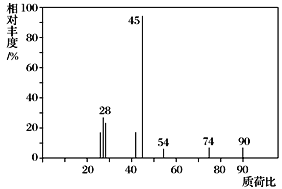
题目内容
【题目】设NA为阿伏加德罗常数的值。下列说法错误的是( )
A.8.7gMnO2与40mL10mol·L-1的浓盐酸充分反应,生成的氯气分子数小于0.1NA
B.0.1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA
C.1.7gH2O2中含有的电子数为0.9NA
D.常温常压下,44g丙烷含有共价键的数目为8NA
【答案】D
【解析】
A.8.7gMnO2的物质的量为0.1mol,40mL10mol·L-1的浓盐酸物质的量为0.4mol,若浓盐酸完全反应生成的氯气为0.1mol,氯气分子数目为0.1NA个,但二氧化锰只能与浓盐酸反应,和稀盐酸不反应,随着反应的进行,浓盐酸变为稀盐酸,不能反应完全,则生成的氯气分子小于0.1NA个,故A正确;
B.MgO和Mg3N2中镁元素的化合价都是+2价,0.1mol镁完全反应失去0.2mol电子,转移的电子数为0.2NA,故B正确;
C.一个H2O2分子中含有18个电子,1.7gH2O2的物质的量为![]() =0.05mol,则含有的电子数为18×0.05×NA=0.9NA,故C正确;
=0.05mol,则含有的电子数为18×0.05×NA=0.9NA,故C正确;
D.一个丙烷分子中含有含有10个共价键,44g丙烷的物质的量为![]() =1mol,则含有共价键的数目为1 ×10×NA=10NA,故D错误;
=1mol,则含有共价键的数目为1 ×10×NA=10NA,故D错误;
答案选D。

【题目】某蓄电池的反应为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2。
Fe(OH)2+Ni(OH)2。
(1)该蓄电池放电时,发生还原反应的物质是________;
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常在船体上镶嵌Zn块,或与该蓄电池的_____ (填“正”或“负”)极相连。
(3)精炼铜时,粗铜应与直流电源的________(填“正”或“负”)极相连。精炼过程中,电解质溶液中的c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解。甲同学设计如下除杂方案:
![]()
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀时的pH | 2.3 | 7.5 | 5.6 |
完全沉淀时的pH | 3.9 | 9.7 | 6.4 |
①实验操作I的名称________ 则加入H2O2的目的是____________________。
②乙同学认为应将方案中的pH调节到8,你认为此观点_____(填“正确”或“不正确”),理由是_________。
(4)该蓄电池充电时阴极的电极反应式为_________________。