题目内容
15.下面是元素周期表的一部分,参照元素①-⑧在表中的位置,请用化学用语回答下列问题:| 族 周期 | IA | O | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是(填化学式)HClO4>H2CO3>H2SiO3.
(3)在①、④、⑤、⑧中的某些元素之间可形成既含离子键又含非极性共价键的离子化合物,写出其中一种化合物的电子式:
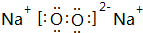 .
.(4)由②和④组成的化合物与⑤的同周期相邻主族元素的单质反应的化学方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(5)⑦单质与⑤的最高价氧化物的水化物反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(6)常温下,由①②④组成最简单的液态有机物可作为燃料电池的原料之一,请写出其在碱性介质中的电极反应式:CH3OH+8OH--6e-=CO32-+4H2O.
分析 由元素在周期表中的位置,可知①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(2)元素非金属性越强,对应的最高价含氧酸的酸性越强;
(3)①、④、⑤、⑧中的某些元素形成既含离子键又含非极性共价键的离子化合物为Na2O2;
(4)⑤的同周期相邻主族元素的单质为Mg,②和④组成的化合物能与Mg反应,则化合物为CO2,Mg再二氧化碳中燃烧生成MgO与碳;
(5)⑦的单质为Al,⑤的最高价氧化物的水化物为NaOH,二者反应生成偏铝酸钠与氢气;
(6)常温下,由①②④组成最简单的液态有机物为CH3OH,甲醇发生氧化反应,在碱性介质中生成碳酸根与水.
解答 解:由元素在周期表中的位置,可知①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Si>O,故答案为:Na>Si>O;
(2)非金属性Cl>C>Si,非金属性越强,最高价含氧酸的酸性越强,故酸性:HClO4>H2CO3>H2SiO3,故答案为:HClO4>H2CO3>H2SiO3;
(3)①、④、⑤、⑧中的某些元素形成既含离子键又含非极性共价键的离子化合物为Na2O2,电子式为 ,故答案为:
,故答案为: ;
;
(4)⑤的同周期相邻主族元素的单质为Mg,②和④组成的化合物能与Mg反应,则化合物为CO2,Mg再二氧化碳中燃烧生成MgO与碳,反应方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(5)⑦的单质为Al,⑤的最高价氧化物的水化物为NaOH,二者反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(6)常温下,由①②④组成最简单的液态有机物为CH3OH,甲醇发生氧化反应,在碱性介质中生成碳酸根与水,电极反应式为:CH3OH+8OH--6e-=CO32-+4H2O,故答案为:CH3OH+8OH--6e-=CO32-+4H2O.
点评 本题考查元素周期表与元素周期律,侧重对元素周期律与化学用语的考查,注意对元素周期表的整体把握,难度中等.

| A. | Fe→FeCl2 | B. | Na→Na2O2 | C. | S→SO3 | D. | N2→NO2 |
| A. | 镁、铝在常温下都能被氧气氧化 | B. | 镁、铝均须密封保存 | ||
| C. | MgO和Al2O3都是碱性氧化物 | D. | 镁铝合金的硬度比镁小 |
| A. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 | |
| D. | F-、O2-、Mg2+、Na+半径逐渐减小 |

| A. | 用装置甲验证在该条件下铁钉发生吸氧腐蚀 | |
| B. | 装置乙用于HCl的吸收,以防倒吸 | |
| C. | 用装置丙验证实验室制得的乙烯中混有二氧化硫和二氧化碳 | |
| D. | 关闭活塞a,从b处加水,以检查装置丁的气密性 |
| A. | O2和O3 | B. | 3517R和3717R | C. | 2311X和2311X+ | D. | 4018R和4020X |

| A. | CO+H2O═CO2+H2 △H=+41 kJ/mol | B. | CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41 kJ/mol | ||
| C. | CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41 kJ/mol | D. | CO2(g)+H2(g)═CO(g)+H2O(g)△H=-41 kJ/mol |
| A. | 如图所示正反应的活化能为E-E 1 | |
| B. | 活化分子具有比普通分子更高的能量 | |
| C. | 反应物的分子的每次碰撞都能发生化学反应 | |
| D. | 反应物分子间的有效碰撞是发生化学反应的充要条件 |
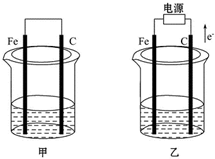 甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题: