题目内容
5.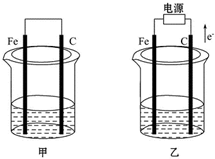 甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题:(1)若甲乙两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的碳棒;乙池中的铁棒.
②在乙池中阳极的电极反应式是4OH--4e-═2H2O+O2↑.
(2)若甲乙两池中均盛放饱和NaCl溶液.
写出甲池中正极的电极反应式O2+4e-+2H2O═4OH-.
乙池中发生反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.
分析 (1)甲池属于原电池,铁易失电子作负极,碳作正极,正极上铜离子得电子发生还原反应;乙池属于电解池,根据电子流向知,C电极为阳极,铁电极为阴极,阴极上铜离子得电子发生还原反应,阳极上氢氧根离子失电子;
(2)①若电解质溶液为氯化钠溶液,则甲中正极上为氧气得电子;
②若电解质溶液为氯化钠溶液,则乙中为电解氯化钠溶液,阳极氯离子失电子,阴极氢离子得电子.
解答 解:(1)甲装置是原电池,铁易失电子作负极,碳作正极,正极上铜离子得电子发生还原反应,生成红色的铜,乙池属于电解池,根据电子流向知,C电极为阳极,铁电极为阴极,阴极上铜离子得电子发生还原反应生成红色的铜,阳极上氢氧根离子失电子生成氧气和水,其电极反应式为:4OH--4e-═2H2O+O2↑;
故答案为:碳;铁;4OH--4e-═2H2O+O2↑;
(2)①若电解质溶液为氯化钠溶液,则甲中正极上为氧气得电子,其电极反应式为:O2+4e-+2H2O═4OH-;
故答案:O2+4e-+2H2O═4OH-;
②若电解质溶液为氯化钠溶液,则乙中为电解氯化钠溶液,阳极氯离子失电子,阴极氢离子得电子,则总反应的离子方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑;
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.
点评 本题综合考查电化学知识,题目侧重于原电池和电解池的原理的考查,注意把握电极反应式的书写,为解答该题的关键,题目难度不大,注意电子的移动方向,为判断电解池的阴极、阳极的关键之处.

练习册系列答案
相关题目
13.下列各物质的名称不正确的是( )
| A. | 3-甲基-2-戊炔 | B. | 3-甲基-2-丁醇 | C. | 3-甲基-1-丁炔 | D. | 2,2-二甲基丁烷 |
20.下列反应属于取代反应的是( )
| A. | Zn+CuSO4 ═ZnSO4+Cu | B. | NaCl+AgNO3═NaNO3+AgCl↓ | ||
| C. | CH3OH+HCOOH→HCOOCH3+H2O | D. | CH4+2Br2 $\stackrel{光照}{→}$ CH2Br2+2HBr |
10.下列化学用语表示不正确的是( )
| A. | 羟基的电子式: | B. | 石炭酸的结构简式:C6H5OH | ||
| C. | 乙醛的分子式:C2H4O | D. | 酚醛树脂的结构简式为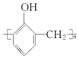 |
17.在一定温度下的定容密闭容器中,下列条件不能表明2A(s)?C(g)+D(g)已达到平衡状态的是( )
| A. | 混合气体的压强不再改变 | |
| B. | 气体C在混合气体中所占的物质的量分数不再改变 | |
| C. | 混合气体的密度不再改变 | |
| D. | 单位时间内消耗n mol C的同时消耗2n mol A |
14.将等物质的量的镁和铝混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是( )
| A. | 3 mol•L-1HCl | B. | 4 mol•L-1HNO3 | ||
| C. | 8 mol•L-1NaOH | D. | 18 mol•L-1浓H2SO4 |
15.下面是元素周期表的一部分,参照元素①-⑧在表中的位置,请用化学用语回答下列问题:
(1)④、⑤、⑦的原子半径由大到小的顺序为(元素符号)Na>Si>O.
(2)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是(填化学式)HClO4>H2CO3>H2SiO3.
(3)在①、④、⑤、⑧中的某些元素之间可形成既含离子键又含非极性共价键的离子化合物,写出其中一种化合物的电子式: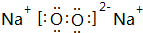 .
.
(4)由②和④组成的化合物与⑤的同周期相邻主族元素的单质反应的化学方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(5)⑦单质与⑤的最高价氧化物的水化物反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(6)常温下,由①②④组成最简单的液态有机物可作为燃料电池的原料之一,请写出其在碱性介质中的电极反应式:CH3OH+8OH--6e-=CO32-+4H2O.
| 族 周期 | IA | O | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是(填化学式)HClO4>H2CO3>H2SiO3.
(3)在①、④、⑤、⑧中的某些元素之间可形成既含离子键又含非极性共价键的离子化合物,写出其中一种化合物的电子式:
 .
.(4)由②和④组成的化合物与⑤的同周期相邻主族元素的单质反应的化学方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(5)⑦单质与⑤的最高价氧化物的水化物反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(6)常温下,由①②④组成最简单的液态有机物可作为燃料电池的原料之一,请写出其在碱性介质中的电极反应式:CH3OH+8OH--6e-=CO32-+4H2O.
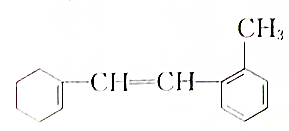 [典型例题√某有机物的结构简式如图:
[典型例题√某有机物的结构简式如图: