题目内容
3.下列说法不正确的是( )| A. | 如图所示正反应的活化能为E-E 1 | |
| B. | 活化分子具有比普通分子更高的能量 | |
| C. | 反应物的分子的每次碰撞都能发生化学反应 | |
| D. | 反应物分子间的有效碰撞是发生化学反应的充要条件 |
分析 A.活化能是活化分子的平均能量与所有分子平均能量之差;
B.能够发生有效碰撞的分子是活化分子,活化分子具有较高能量;
C.反应物分子间反应时必须先发生碰撞;
D.反应物分子的每次碰撞不一定都能发生化学反应.
解答 解:A.活化能是活化分子的平均能量与所有分子平均能量之差,图中是E-E1,故A正确;
B.能够发生有效碰撞的分子是活化分子,活化分子具有比普通分子更高的能量,故B正确;
C.反应物分子的每次碰撞不一定能发生化学反应,只有活化分子的有效碰撞才能发生化学反应,故C错误;
D.反应物分子间的每次碰撞是反应的先决条件,活化分子的有效碰撞是发生化学反应的充要条件,故D正确.
故选C.
点评 本题考查了活化能对化学反应速率的影响,难度不大,会分析“能量与反应过程的图象中哪部分表示活化能,哪部分表示反应热”.

练习册系列答案
相关题目
15.下面是元素周期表的一部分,参照元素①-⑧在表中的位置,请用化学用语回答下列问题:
(1)④、⑤、⑦的原子半径由大到小的顺序为(元素符号)Na>Si>O.
(2)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是(填化学式)HClO4>H2CO3>H2SiO3.
(3)在①、④、⑤、⑧中的某些元素之间可形成既含离子键又含非极性共价键的离子化合物,写出其中一种化合物的电子式: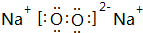 .
.
(4)由②和④组成的化合物与⑤的同周期相邻主族元素的单质反应的化学方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(5)⑦单质与⑤的最高价氧化物的水化物反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(6)常温下,由①②④组成最简单的液态有机物可作为燃料电池的原料之一,请写出其在碱性介质中的电极反应式:CH3OH+8OH--6e-=CO32-+4H2O.
| 族 周期 | IA | O | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是(填化学式)HClO4>H2CO3>H2SiO3.
(3)在①、④、⑤、⑧中的某些元素之间可形成既含离子键又含非极性共价键的离子化合物,写出其中一种化合物的电子式:
 .
.(4)由②和④组成的化合物与⑤的同周期相邻主族元素的单质反应的化学方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(5)⑦单质与⑤的最高价氧化物的水化物反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(6)常温下,由①②④组成最简单的液态有机物可作为燃料电池的原料之一,请写出其在碱性介质中的电极反应式:CH3OH+8OH--6e-=CO32-+4H2O.
15. 向Al2(SO4)溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系如图所示,资料表明Ba( AlO2)2可溶于水.下列有关叙述错误的是( )
向Al2(SO4)溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系如图所示,资料表明Ba( AlO2)2可溶于水.下列有关叙述错误的是( )
 向Al2(SO4)溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系如图所示,资料表明Ba( AlO2)2可溶于水.下列有关叙述错误的是( )
向Al2(SO4)溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系如图所示,资料表明Ba( AlO2)2可溶于水.下列有关叙述错误的是( )| A. | 线段ob:Al(OH)3沉淀和BaSO4沉淀共存 | |
| B. | 线段cd:溶液中n(AlO2)>(Ba2+) | |
| C. | 线段ad:n(BaSO4)≥n[Al(OH)3] | |
| D. | 线段de:溶液中n(Ba2+)始终不等于n(OH-) |
12.铜锌原电池(如图)工作时,下列叙述正确的是( )
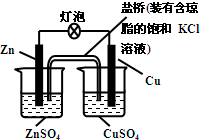

| A. | 一段时间后,铜棒上有红色物质析出 | |
| B. | 正极反应为:Zn-2e-═Zn2+ | |
| C. | 在外电路中,电流从负极流向正极 | |
| D. | 盐桥中的K+移向ZnSO4溶液 |
14. 下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务.
下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务.
I.课本介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2mL乙醇的试管里,反复操作几次.注意闻生成物的气味,并观察铜丝表面的变化.
(1)小赵同学用化学方法替代“闻生成物的气味”来说明生成物的出现,该化学方法中所另加的试剂及出现的主要现象是银氨溶液,出现银镜或新制氢氧化铜悬浊液,产生砖红色沉淀.(用所学的知识回答)
(2)小赵同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入足量的乙醛溶液,可以看到溴水褪色.该同学为解释上述现象,提出三种猜想:
①溴与乙醛发生取代反应;
②溴与乙醛发生加成反应;
③由于醛基具有还原性,溴将乙醛氧化为乙酸.
为探究哪种猜想正确,小李同学提出了如下两种实验方案:
方案一:用pH试纸检测溴水褪色后溶液的酸碱性;
方案二:测定反应前溴水中Br2的物质的量和反应后溶液中Br-的物质的量.
(3)方案一是否可行否(填“是”或“否”),理由是不论是发生取代反应还是发生氧化反应,溶液的酸性均增强.
(4)小李同学认为:假设测得反应前溴水中Br2的物质的量为amol,若测得反应后n(Br-)=amol,则说明溴与乙醛发生取代反应.
(5)小吴同学设计如下实验方案:
①按物质的量之比为1:5配制KBrO3-KBr溶液,加合适的适量的酸,完全反应并稀至1L,生成0.5molBr2.
②取上述溶液10mL加入足量乙醛溶液,使之褪色,然后将所得溶液稀释为100mL,准确量取其中10mL.
③加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到淡黄色固体0.188g.
试通过计算判断:溴与乙醛发生反应的化学方程式为CH3CHO+Br2+H2O→CH3COOH+2HBr.
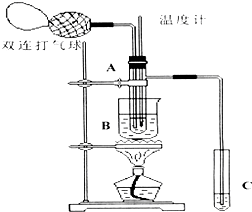
Ⅱ.小刘同学在查阅资料时得知,乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见表:
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)2CH3CHO+O2$→_{CuO}^{60℃-80℃}$2CH3COOH.
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A的反应液中;目的是测量反应溶液的温度;当试管A内的主要反应完成后温度计水银球的位置应在略低于试管A的支管口处,目的是收集含乙酸的馏分.
(3)烧杯B内盛装的液体可以是乙二醇或甘油(写出一种即可,在题给物质中找).
 下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务.
下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务.I.课本介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2mL乙醇的试管里,反复操作几次.注意闻生成物的气味,并观察铜丝表面的变化.
(1)小赵同学用化学方法替代“闻生成物的气味”来说明生成物的出现,该化学方法中所另加的试剂及出现的主要现象是银氨溶液,出现银镜或新制氢氧化铜悬浊液,产生砖红色沉淀.(用所学的知识回答)
(2)小赵同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入足量的乙醛溶液,可以看到溴水褪色.该同学为解释上述现象,提出三种猜想:
①溴与乙醛发生取代反应;
②溴与乙醛发生加成反应;
③由于醛基具有还原性,溴将乙醛氧化为乙酸.
为探究哪种猜想正确,小李同学提出了如下两种实验方案:
方案一:用pH试纸检测溴水褪色后溶液的酸碱性;
方案二:测定反应前溴水中Br2的物质的量和反应后溶液中Br-的物质的量.
(3)方案一是否可行否(填“是”或“否”),理由是不论是发生取代反应还是发生氧化反应,溶液的酸性均增强.
(4)小李同学认为:假设测得反应前溴水中Br2的物质的量为amol,若测得反应后n(Br-)=amol,则说明溴与乙醛发生取代反应.
(5)小吴同学设计如下实验方案:
①按物质的量之比为1:5配制KBrO3-KBr溶液,加合适的适量的酸,完全反应并稀至1L,生成0.5molBr2.
②取上述溶液10mL加入足量乙醛溶液,使之褪色,然后将所得溶液稀释为100mL,准确量取其中10mL.
③加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到淡黄色固体0.188g.
试通过计算判断:溴与乙醛发生反应的化学方程式为CH3CHO+Br2+H2O→CH3COOH+2HBr.
Ⅱ.小刘同学在查阅资料时得知,乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见表:
| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)2CH3CHO+O2$→_{CuO}^{60℃-80℃}$2CH3COOH.
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A的反应液中;目的是测量反应溶液的温度;当试管A内的主要反应完成后温度计水银球的位置应在略低于试管A的支管口处,目的是收集含乙酸的馏分.
(3)烧杯B内盛装的液体可以是乙二醇或甘油(写出一种即可,在题给物质中找).
11. 如图中X、Y分别是直流电源的两极,通电后发现a极板的质量增加,b极板上有无色无味的气体产生.下列符合此现象的是( )
如图中X、Y分别是直流电源的两极,通电后发现a极板的质量增加,b极板上有无色无味的气体产生.下列符合此现象的是( )
 如图中X、Y分别是直流电源的两极,通电后发现a极板的质量增加,b极板上有无色无味的气体产生.下列符合此现象的是( )
如图中X、Y分别是直流电源的两极,通电后发现a极板的质量增加,b极板上有无色无味的气体产生.下列符合此现象的是( )| a极板 | b极板 | Y电极 | c溶液 | |
| A | 锌 | 石墨 | 负极 | CuSO4 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 银 | 铁 | 正极 | AgNO3 |
| D | 石墨 | 石墨 | 负极 | CuCl2 |
| A. | A | B. | B | C. | C | D. | D |
9.在烧瓶中充入干燥的标准状况下的HCl和N2的混合气体,已知其相对分子质量为34.8,把烧瓶倒置在水槽中,如果溶质没有扩散,所得溶液的物质的量浓度是( )
| A. | 0.022mol/L | B. | 0.8mol/L | C. | 0.045mol/L | D. | 1.0mol/L |

