题目内容
10.根据原子结构及元素周期律的知识,下列推断正确的是( )| A. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 | |
| D. | F-、O2-、Mg2+、Na+半径逐渐减小 |
分析 A.元素非金属性越强,最高价含氧酸的酸性越强;
B.核外电子排布相同的微粒,化学性质不一定相同,如Ar原子与S2-离子;
C.互为同位素原子的化学性质相同;
D.电子层结构相同的离子,核电荷数越大离子半径越小.
解答 解:A.同主族元素最高价含氧酸自上而下酸性减弱,不是最高价含氧酸不一定,如HClO为弱酸、HBrO4为强酸,故A错误;
B.核外电子排布相同的微粒,化学性质不一定相同,如Ar原子化学性质稳定,而S2-离子具有强还原性,故B错误;
C.3517Cl与3717Cl核外同位素,得电子能力相同,故C正确;
D.F-、O2-、Mg2+、Na+电子层结构相同,核电荷数越大离子半径越小,故离子半径:O2->F->Na+>Mg2+,故D错误,
故选:C.
点评 本题考查元素周期律、原子结构与性质、微粒半径比较,题目难度不大,侧重对基础知识的巩固.

练习册系列答案
相关题目
20.下列反应属于取代反应的是( )
| A. | Zn+CuSO4 ═ZnSO4+Cu | B. | NaCl+AgNO3═NaNO3+AgCl↓ | ||
| C. | CH3OH+HCOOH→HCOOCH3+H2O | D. | CH4+2Br2 $\stackrel{光照}{→}$ CH2Br2+2HBr |
1.下列有关化学用语等问题中不正确的是( )
| A. | CH4分子的比例模型: | B. | 2-甲基-1,3-丁二烯的键线式  | ||
| C. | 乙炔分子的电子式:H:C┇┇C:H | D. | 乙烯的结构简式:CH2CH2 |
18.用NA表示阿伏伽德罗常数,下列有关说法正确的是( )
| A. | lmol OH一中含有9 NA个电子 | |
| B. | 46g NO2和N2O4混合物中所含原子数目为3NA | |
| C. | 常温常压下50g 46%的乙醇溶液中,所含氧原子数目为0.5NA | |
| D. | .常温下,56g铁粉与足量浓硝酸反应,电子转移数目小于3NA |
5.下列各组离子,在指定的环境中一定能大量共存的是( )
| A. | 在pH=0的溶液中:Fe2+、Mg2+、SO42-、NO3- | |
| B. | 能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- | |
| C. | 常温下c(H+)/c(OH-)=1012的溶液:Fe3+、Mg2+、NO3-、Cl- | |
| D. | 不能使酚酞变红的无色溶液:Na+、CO32-、K+、ClO-、AlO2- |
15.下面是元素周期表的一部分,参照元素①-⑧在表中的位置,请用化学用语回答下列问题:
(1)④、⑤、⑦的原子半径由大到小的顺序为(元素符号)Na>Si>O.
(2)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是(填化学式)HClO4>H2CO3>H2SiO3.
(3)在①、④、⑤、⑧中的某些元素之间可形成既含离子键又含非极性共价键的离子化合物,写出其中一种化合物的电子式: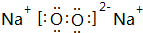 .
.
(4)由②和④组成的化合物与⑤的同周期相邻主族元素的单质反应的化学方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(5)⑦单质与⑤的最高价氧化物的水化物反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(6)常温下,由①②④组成最简单的液态有机物可作为燃料电池的原料之一,请写出其在碱性介质中的电极反应式:CH3OH+8OH--6e-=CO32-+4H2O.
| 族 周期 | IA | O | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是(填化学式)HClO4>H2CO3>H2SiO3.
(3)在①、④、⑤、⑧中的某些元素之间可形成既含离子键又含非极性共价键的离子化合物,写出其中一种化合物的电子式:
 .
.(4)由②和④组成的化合物与⑤的同周期相邻主族元素的单质反应的化学方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(5)⑦单质与⑤的最高价氧化物的水化物反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(6)常温下,由①②④组成最简单的液态有机物可作为燃料电池的原料之一,请写出其在碱性介质中的电极反应式:CH3OH+8OH--6e-=CO32-+4H2O.
2.下列有关离子方程式与所述事实相符且正确的是( )
| A. | Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 用氯化铁溶液和沸水反应制取氢氧化铁胶体:Fe3++3H2O(沸水)═Fe(OH)3↓+3H+ | |
| D. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- |
