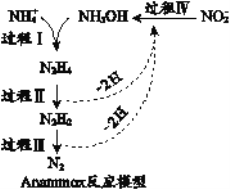
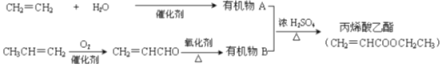
题目内容
【题目】已知: 2NO2(g)+ CH4(g)![]() N2(g)+ CO2(g)+ 2H2O(g) ΔH,向容积为2L的恒容密闭容器中,充入NO2和CH4的混合气体0.3mol充分反应。不同投料比时,NO2的平衡转化率与温度的关系如右图所示。[投料比=
N2(g)+ CO2(g)+ 2H2O(g) ΔH,向容积为2L的恒容密闭容器中,充入NO2和CH4的混合气体0.3mol充分反应。不同投料比时,NO2的平衡转化率与温度的关系如右图所示。[投料比=![]() ] ;下列说法不正确的是
] ;下列说法不正确的是

A. ΔH < 0
B. X > 2
C. 400K时,反应的平衡常数为5×10-2
D. 投料比为2时,Q点v逆(CH4)小于P点的v逆(CH4)
【答案】C
【解析】A、根据图像,随着温度升高,NO2的转化率降低,说明升高温度,平衡向逆反应方向移动,即△H<0,故A说法正确;B、增加投料比,即可以认为增大n(NO2),相同温度下,在等于2的基础上增大n(NO2),根据勒夏特列原理,平衡向逆反应方向移动,NO2的转化率降低,即X>2,故B说法正确;C、400K时,投料比为2,即n(NO2)=0.2mol,n(CH4)=0.1mol,
2NO2(g)+ CH4(g)![]() N2(g)+ CO2(g)+ 2H2O(g)
N2(g)+ CO2(g)+ 2H2O(g)
起始: 0.2 0.1 0 0 0
变化: 0.2×50% 0.1×50% 0.1×50% 0.1×50% 0.1×50%
平衡: 0.1 0.05 0.05 0.05 0.05,K=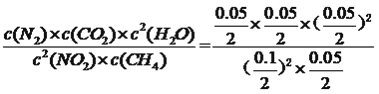 =6.25×10-4,故C错误;D、Q点移向P点,NO2的转化率增大,平衡向正反应方向移动,逆反应速率逐渐增大,即Q点v逆(CH4)小于P点的v逆(CH4),故D说法正确。
=6.25×10-4,故C错误;D、Q点移向P点,NO2的转化率增大,平衡向正反应方向移动,逆反应速率逐渐增大,即Q点v逆(CH4)小于P点的v逆(CH4),故D说法正确。

 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案【题目】一定温度下,在三个体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g)CH3OCH3(g)+H2O(g)
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
下列说法正确的是( )
A.该反应的正反应为放热反应
B.达到平衡时,容器Ⅰ中的CH3OH体积分数比容器Ⅱ中的小
C.容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的长
D.若起始时向容器Ⅰ中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
【题目】原子序数依次增加的前四周期的主族元素A~I,有关性质如下:
元素代号 | A | B | C | D | E | F | G | H | I |
原子半径/nm | 0.037 | 0.074 | 0.073 | 0.071 | 0.143 | 0.102 | 0.099 | 0.197 | 0.114 |
主要化合价 | +1 | +5、-3 | -2 | -1 | +4、-4 | +6、-2 | +7、-1 | +2 | +7、-1 |
已知E的单质是一种常见的半导体材料,分析表中数据,回答有关问题:
(1)元素G在周期表中的位置是_______,元素C的气态氢化物的电子式为_______。
(2)元素A、B、G可形成化合物B A4G,该化合物中存在的化学键有_______, E的单质晶体属于_______晶体(填“离子”、“分子”或“原子”),
(3)元素D、G、I的非金属性由强到弱的顺序是________(用元素符号表示),
(4)元素C、D的气态氢化物的稳定性顺序为_______(用化学式表示),元素D的单质可以将元素C从化合物A2C中置换出来,该置换反应的化学方程式为_______。