题目内容
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)  2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始、平衡时的有关数据如下表:
2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始、平衡时的有关数据如下表:
| 容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15 kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数相等
C.容器②中达平衡时放出的热量Q=23.15 kJ
D.若容器①体积为0.5 L,则平衡时放出的热量<23.15 kJ
C
解析试题分析:A、平衡常数只与温度有关,相同温度下,体积均为0.25L的两个恒容密闭容器中发生相同的反应,则平衡常数应相同,故A正确;
B、①容器中放出23.15kJ热量,则生成氨气的物质的量为: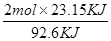 =0.5mol,利用三段式法计算:
=0.5mol,利用三段式法计算:
N2(g)+3H2(g)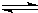 2NH3(g) △H=一92.6kJ/mol
2NH3(g) △H=一92.6kJ/mol
起始:1mol 3mol 0
转化:0.25mol 0.75mol 0.5mol
平衡:0.75mol 2.25mol 0.5mol
平衡时,①容器中NH3的体积分数等于气体的物质的量分数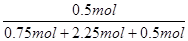 =0.7,
=0.7,
从等效平衡的角度分析,1molN2、2.5molH2和0.2molNH3相当于1molN2、3molH2,在相同条件下处于相同平衡状态,所以平衡时两个容器内氨气的体积分数相等,正确;C、②中含有0.2molNH3相当在①的基础上加入氨气,抑制平衡正向移动,则平衡时放出的热量小于23.15kJ,错误; D、若容器①体积为0.5L,相当于在原来的基础上减小压强,平衡逆向移动,平衡时放出的热量小于23.15kJ,正确。
考点:本题考查化学平衡移动问题,题目难度不大,注意B项从等效平衡的角度分析,为该题的易错点。

 考前必练系列答案
考前必练系列答案在一密闭容器中进行如下反应:2SO2(气)+O2(气) 2SO3(气),已知反应过程中某一时SO2、O2、SO3,的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
2SO3(气),已知反应过程中某一时SO2、O2、SO3,的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
| A.SO2为0.4mol/L、O2为0.2mol/L | B.SO3为0.4mol/L |
| C.SO2、S03均为0.15mol/L | D.SO2为0.25mol/L |
下列事实中,不能用勒夏特列原理解释的是
| A.密闭、低温是存放氨水的必要条件 |
| B.实验室常用排饱和食盐水法收集氯气 |
| C.硝酸工业生产中,使用过量空气以提高NH3的利用率 |
| D.合成氨反应采用较高温度和使用催化剂,以提高氨气的产量 |
已知甲为恒压容器、乙为恒容容器。相同条件下充入等物质的量的NO2气体,且起始时体积相同。发生反应:2NO2(g) N2O4 (g) △H<0。一段时间后相继达到平衡状态。下列说法中正确的是
N2O4 (g) △H<0。一段时间后相继达到平衡状态。下列说法中正确的是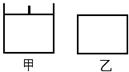
| A.平衡时NO2体积分数:甲<乙 |
| B.达到平衡所需时间,甲与乙相等 |
| C.该反应的平衡常数表达式K=c(N2O4)/c(NO2) |
| D.若两容器内气体的压强保持不变,均说明反应已达到平衡状态 |
在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,不能说明反应
A(s)+2B(g) C(g)+D(g)已达平衡状态的是( )
C(g)+D(g)已达平衡状态的是( )
| A.混合气体的压强 | B.混合气体的密度 |
| C.气体的平均相对分子质量 | D.B的物质的量浓度 |
将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g) 2 HBr(g)△H<0,平衡时Br2转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2转化率为b,则a、b的关系是
2 HBr(g)△H<0,平衡时Br2转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2转化率为b,则a、b的关系是
| A.a>b | B.a=b | C.a<b | D.无法确定 |
下列说法正确的是( )
| A.凡是放热反应都是自发的,因为吸热反应都是非自发的 |
| B.熵增加的放热反应一定能自发进行 |
| C.自发反应一定是熵增大,非自发反应一定是熵减小或不变 |
| D.自发反应在任何条件下都能实现 |
下列情况下的反应一定能自发进行的是
| A.ΔH>0 ΔS<0 | B.ΔH>0 ΔS>0 |
| C.ΔH<0 ΔS<0 | D.ΔH<0 ΔS>0 |
已知在某密闭容器中发生反应 4NH3+5O2=4NO+6H2O,若反应速率分别用
υ(NH3)、υ(O2)、υ(NO)、υ(H2O)表示,则下列关系正确的是
A.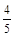 υ(NH3) =υ(O2) υ(NH3) =υ(O2) | B.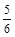 υ(O2) =υ(H2O) υ(O2) =υ(H2O) |
C.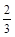 υ(NH3) =υ(H2O) υ(NH3) =υ(H2O) | D.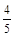 υ(O2) =υ(NO) υ(O2) =υ(NO) |