题目内容
X、Y、Z、M、W为原子序数依次增大的5种短周期元素.X的质子总数与电子层数相同,Y、Z、M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍.Z与其同主族的短周期元素可形成常见气体甲.X、Y、Z 3种元素形成化合物乙.下列说法不正确的是( )
| A、原子半径:W>Y>Z>M>X |
| B、化合物乙中一定只有共价键 |
| C、由W元素形成的单质以及W与Z两元素形成的化合物都是原子晶体 |
| D、X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM,沸点X2Z>XM |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:X、Y、Z、M、W为原子序数依次增大的5种短周期元素.X的质子总数与电子层数相同,则X为H元素;Y、Z、M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍,而Z与其同主族的短周期元素可形成常见气体甲(甲有刺激性气味),则Z为O元素,可推知Y为N元素、M为F元素、W为Si,故甲为SO2,X、Y、Z 三种元素形成化合物乙为HNO3、NH4NO3等.
解答:
解:X、Y、Z、M、W为原子序数依次增大的5种短周期元素.X的质子总数与电子层数相同,则X为H元素;
Y、Z、M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍,而Z与其同主族的短周期元素可形成常见气体甲(甲有刺激性气味),则Z为O元素,可推知Y为N元素、M为F元素、W为Si,故甲为SO2,X、Y、Z 三种元素形成化合物乙为HNO3、NH4NO3等,
A.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径Si>N>O>F>H,故A正确;
B.化合物乙若为NH4NO3,属于离子晶体,含有离子键,故B错误;
C.Si单质属于原子晶体,W与Z两元素形成的化合物是二氧化硅,属于原子晶体,故C正确;
D.非金属性F最强,故氢化物中HF最稳定,常温下水为液态,而HF为气体,故沸点沸点H2O>HF,故D正确,
故选B.
Y、Z、M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍,而Z与其同主族的短周期元素可形成常见气体甲(甲有刺激性气味),则Z为O元素,可推知Y为N元素、M为F元素、W为Si,故甲为SO2,X、Y、Z 三种元素形成化合物乙为HNO3、NH4NO3等,
A.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径Si>N>O>F>H,故A正确;
B.化合物乙若为NH4NO3,属于离子晶体,含有离子键,故B错误;
C.Si单质属于原子晶体,W与Z两元素形成的化合物是二氧化硅,属于原子晶体,故C正确;
D.非金属性F最强,故氢化物中HF最稳定,常温下水为液态,而HF为气体,故沸点沸点H2O>HF,故D正确,
故选B.
点评:本题考查结构性质位置关系应用,难度中等,推断元素是解题关键,注意乙物质的不确定性,识记常见的原子晶体.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
能正确表示下列反应的离子方程式是( )
| A、FeO溶于足量稀HNO3:FeO+2H+═Fe2++H2O |
| B、NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| C、等物质的量的KHCO3和Ba(OH)2的溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| D、将0.2mol/L的NH4Al(SO4)2溶液与0.4mol/L的Ba(OH)2溶液等体积混合2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
等物质的量的下列物质完全燃烧时,消耗氧气的量最多的是( )
| A、C2H4 |
| B、C2H6 |
| C、C2H5OH |
| D、CH3COOH |
设NA 表示阿伏加德罗常数的值.下列说法正确的是(已知相对原子质量H:1、O:16)( )
| A、0.1mol/L AlCl3溶液中Al3+浓度为0.1mol/L |
| B、常温常压下,18g H2O中含有的原子总数为3NA |
| C、1mol羟基中含有10NA个电子 |
| D、常温常压下,2.24L CO和CO2混合气体中含有的碳原子数目为0.1NA |
下列关系正确的是( )
| A、将等物质的量的H2CO3和KHCO3溶于水配成的溶液中:2c(K+)=c(H2CO3)+c(HCO3-) |
| B、向CH3COONa溶液里加入适量的NaOH固体后得到的混合溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| C、向0.10mol?L-1 NH4HSO4溶液中滴加适量的NaOH溶液至溶液呈中性,该中性溶液中:c(Na+)>c(SO42-)>c(NH4+)>c(OH-) |
| D、向NaCN溶液中滴加适量的稀盐酸使溶液呈中性,该中性溶液中:c(Cl-)>c(Na+)>c(HCN) |
在石油化工及煤化工中,下列加工工艺只发生物理变化的是( )
| A、分馏 | B、干馏 | C、裂解 | D、裂化 |
下列有关元素周期表的说法中,正确的是( )
| A、能生成碱的金属元素都在ⅠA族 |
| B、原子序数为14的元素位于元素周期表的第3周ⅥA族 |
| C、稀有气体元素原子的最外层电子数为2或8 |
| D、元素周期表有18个纵行,分列16个族,即7个主族、8个副族和1个0族 |
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、1mol Na与乙醇完全反应,失去2NA电子 |
| B、常温常压下,16g CH4含有10NA个电子 |
| C、1L 0.1mol?L-1的醋酸溶液中含有0.1NA个H+ |
| D、标准状况下,22.4L苯含有NA个苯分子 |
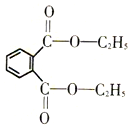 邻苯二甲酸酯类是一类能使塑料柔软的增塑剂,它可能影响胎儿和婴幼儿体内荷尔蒙分泌,引发激素失调,导致儿童性早熟,是可疑致癌物.下列关于邻苯二甲酸二乙酯(结构如图所示)的说法不正确的是( )
邻苯二甲酸酯类是一类能使塑料柔软的增塑剂,它可能影响胎儿和婴幼儿体内荷尔蒙分泌,引发激素失调,导致儿童性早熟,是可疑致癌物.下列关于邻苯二甲酸二乙酯(结构如图所示)的说法不正确的是( )| A、不溶于水,可溶于乙醇、醋酸等有机溶剂 |
| B、既能发生加成反应,也能发生取代反应 |
| C、1mol该物质恰好能与2mol NaOH完全反应 |
| D、0.1mol该物质充分燃烧需要标准状况的氧气32L |