题目内容
除去下列物质中的杂质,所用试剂和方法不正确的是( )
| 物质 | 杂质 | 除杂质所用试剂和方法 | |
| A | KCl溶液 | I2 | CCl4,萃取分液 |
| B | CO2 | HCl | 饱和NaHCO3溶液,洗气 |
| C | FeCl3溶液 | FeCl2 | 过量还原铁粉,过滤 |
| D | Mg粉 | Al粉 | 足量NaOH溶液,过滤 |
| A、A | B、B | C、C | D、D |
考点:物质的分离、提纯的基本方法选择与应用
专题:化学实验基本操作
分析:A.碘不易溶于水,易溶于有机溶剂;
B.碳酸氢钠与盐酸反应生成二氧化碳;
C.Fe与氯化铁反应生成氯化亚铁;
D.Al与NaOH溶液反应,而Fe不能.
B.碳酸氢钠与盐酸反应生成二氧化碳;
C.Fe与氯化铁反应生成氯化亚铁;
D.Al与NaOH溶液反应,而Fe不能.
解答:
解:A.碘不易溶于水,易溶于有机溶剂,则加CCl4,萃取分液可除杂,故A正确;
B.碳酸氢钠与盐酸反应生成二氧化碳,则利用饱和NaHCO3溶液,洗气可除杂,故B正确;
C.Fe与氯化铁反应生成氯化亚铁,将原物质反应掉,不符合除杂原则,应利用氯水来除杂,故C错误;
D.Al与NaOH溶液反应,而Fe不能,则加足量NaOH溶液,过滤可除杂,故D正确;
故选C.
B.碳酸氢钠与盐酸反应生成二氧化碳,则利用饱和NaHCO3溶液,洗气可除杂,故B正确;
C.Fe与氯化铁反应生成氯化亚铁,将原物质反应掉,不符合除杂原则,应利用氯水来除杂,故C错误;
D.Al与NaOH溶液反应,而Fe不能,则加足量NaOH溶液,过滤可除杂,故D正确;
故选C.
点评:本题考查物质分离提纯方法的选择和应用,为高频考点,把握物质的性质及性质差异为解答的关键,侧重混合物除杂的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
某醇在适当条件下与足量的乙酸发生酯化,得到的酯的相对分子质量a与原来醇的相对分子量b的关系是a=b+84,有关该醇应该具有的结构特点的描述正确的是( )
| A、该醇分子中一定具有甲基 |
| B、该醇分子中一定没有甲基 |
| C、该醇分子中至少含有三个碳原子 |
| D、该醇分子中具有两个醇羟基 |
香柠檬油可用于化妆品.香柠檬油含微量的香柠檬酚和香柠檬醚,其结构如图.下列说法正确的是( )
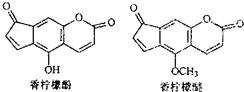

| A、香柠檬醚的分子式为C13H6O4 |
| B、1mol香柠檬酚最多可与2mol Br2发生反应 |
| C、香柠檬酚通过取代反应可转化成香柠檬醚 |
| D、1mol香柠檬酚在NaOH溶液中,最多能消耗2mol NaOH |
下列说法正确的是( )
| A、用NaOH溶液区分乙醇和乙醛 |
| B、可用饱和Na2CO3溶液除去CO2中的SO2 |
| C、实验室用浓硫酸干燥Cl2或H2 |
| D、仅用新制Cu(OH)2检验淀粉水解程度 |
下列说法正确的是( )
| A、氯化钠熔化或氯化氢溶于水时都要破坏化学键 |
| B、常温常压下,18g D2O含有6.02×1024个电子 |
| C、标准状况下,11.2L SO3所含3.01×1023个分子 |
| D、离子化合物中可能含有共价键,共价化合物中一定不含有离子键 |
镭是元素周期表中第7周期第ⅡA族元素,下列关于镭的性质描述不正确的是( )
| A、在化合物中呈+2价 |
| B、单质能与水反应放出氢气 |
| C、氢氧化镭比氢氧化钙的碱性弱 |
| D、碳酸镭难溶于水 |
下列化学用语表述正确的是( )
| A、CH3COONH4的电离方程式为:CH3COONH4═CH3COO-+NH4+ | ||||
| B、NaHS的水解方程式为:HS-+H2O═S2-+H3O+ | ||||
| C、次氯酸的结构式为:H-O-Cl | ||||
D、过量Fe粉与Cl2反应的化学方程式为:Fe+Cl2
|