题目内容
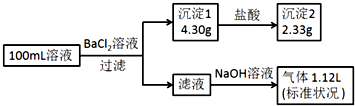
【题目】取100mL等物质的量浓度的硝酸和硫酸混合溶液,当加入200mL 1.5molL﹣1的Ba(OH)2溶液时,溶液显中性.请计算:
(1)原混合液中H+的物质的量浓度为molL﹣1 .
(2)当原混合液中加入0.5molCu,最终剩余铜的质量为g.
【答案】
(1)6
(2)17.6
【解析】解:(1)混合溶液呈中性,说明酸碱恰好完全反应生成盐和水,则酸中n(H+)=n(OH﹣),设原溶液中c(H+)=xmol/L,则xmol/L×0.1L=1.5mol/L×2×0.2L,x=6,
所以答案是:6;(2)因为两种酸的物质的量相等,则硝酸和硫酸中氢离子浓度之比为1:2,c(H+)=6mol/L,则两种酸的浓度都是2mol/L,n(HNO3)=n(H2SO4)=2mol/L×0.1L=0.2mol,Cu和硝酸反应离子方程式为3Cu+8H++2NO3﹣═3Cu2++2NO↑+4H2O,原酸溶液中n(H+)=6mol/L×0.1L=0.6mol,根据N原子守恒得n(NO3﹣)=n(HNO3)=0.2mol,
根据方程式知,如果硝酸根离子完全反应,则需要n(H+)=0.8mol>0.6mol,所以氢离子不足量,以氢离子为标准进行计算,则n(Cu)= ![]() =0.225mol,则剩余m(Cu)=(0.5﹣0.225)mol×64g/mol=17.6g,
=0.225mol,则剩余m(Cu)=(0.5﹣0.225)mol×64g/mol=17.6g,
所以答案是:17.6.

练习册系列答案
相关题目