题目内容
常温下,对pH=10的NaHCO3溶液中,各微粒的物质的量浓度分析正确的是( )
| A、c(CO32-)>c(H2CO3) |
| B、c(Na+)>c(HCO3-)>c(H+)>c(OH-) |
| C、c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
| D、c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:常温下,对pH=10的NaHCO3溶液中,HCO3-水解程度大于电离程度导致溶液呈碱性,溶液中存在电荷守恒和物料守恒,据此分析解答.
解答:
解:A.HCO3-水解程度大于电离程度导致溶液呈碱性,则c(CO32-)<c(H2CO3),故A错误;
B.HCO3-水解程度大于电离程度导致溶液呈碱性,但都较微弱,所以c(H+)<c(OH-),故B错误;
C.溶液中存在电荷守恒,根据电荷混合得c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故C错误;
D.溶液中存在物料守恒,根据物料守恒得c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),故D正确;
故选D.
B.HCO3-水解程度大于电离程度导致溶液呈碱性,但都较微弱,所以c(H+)<c(OH-),故B错误;
C.溶液中存在电荷守恒,根据电荷混合得c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故C错误;
D.溶液中存在物料守恒,根据物料守恒得c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),故D正确;
故选D.
点评:本题考查了离子浓度大小比较,根据溶液酸碱性确定碳酸氢根离子水解程度和电离程度相对大小,再结合守恒思想分析解答,题目难度不大.

练习册系列答案
相关题目
下列化学用语中表述正确的是( )
A、甲醛的电子式: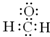 |
| B、二氧化硅的分子式SiO2 |
C、丙烷的分子球棍模型示意图: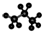 |
D、818O2-离子结构示意图: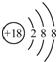 |
下列说法中正确的是( )
| A、向沸水中滴加饱和FeCl3溶液有红褐色沉淀产生 |
| B、制备AlCl3、CuCl2均可以采用将溶液直接蒸干的方法 |
| C、Ksp数值越大的难溶电解质在水中的溶解能力不一定越强 |
| D、向碳酸钡沉淀中加入稀硫酸,沉淀发生转化,可推知硫酸钡的Ksp比碳酸钡的大 |
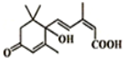 2012年广州市大街小巷对大量盆栽鲜花施用了诱抗素剂,以保证鲜花盛开,诱抗素的分子结构如图,下列关于该分子说法正确的是( )
2012年广州市大街小巷对大量盆栽鲜花施用了诱抗素剂,以保证鲜花盛开,诱抗素的分子结构如图,下列关于该分子说法正确的是( )| A、诱抗素含有碳碳双键、羟基、羰基、羧基 |
| B、诱抗素能与氯化铁溶液发生显色反应 |
| C、诱抗素能发生加成反应、水解反应、氧化反应 |
| D、1mol诱抗素在一定条件下可分别与4mol H2、2mol NaOH发生反应 |
2012年3月11日衡耒高速公路耒阳路段一辆运送化学物品的槽罐车侧翻,罐内15t苯泄入路边300m长的水渠,造成严重危险,许多新闻媒体进行了连续报道,以下报道中有科学性错误的是( )
| A、处理事故时,由于事故发生地周围比较空旷,有人提出用点火焚烧的办法来清除泄漏物,但由于苯燃烧会产生大量的黑烟扩大污染,所以该办法未被采纳 |
| B、由于苯是一种易挥发、易燃的物质,周围地区如果有一个火星就可能引起爆炸 |
| C、可以采取抽吸水渠中上层液体的办法,达到清除泄漏物的目的 |
| D、由于大量苯溶于水中渗入土壤,会对周边农田、水源造成严重污染 |
下列说法错误的是( )
A、
| ||||
B、
| ||||
| C、14C和14N的质量数相等,它们的中子数不等 | ||||
| D、12C和14C互为同位素,物理性质不同,但化学性质几乎完全相同 |
下列物质在水溶液中既能电离又能水解的是( )
| A、NH4Cl |
| B、NaHS |
| C、HNO3 |
| D、HClO |
强酸与强碱的稀溶液发生中和反应的反应为H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1,分别向1L 0.5mol?L-1的NaOH溶液中加入:①稀盐酸,②浓硫酸,③稀硝酸.恰好完全反应的反应热分别为△H1、△H2、△H3,它们之间的关系正确的是( )
| A、△H1>△H2>△H3 |
| B、△H2<△H1<△H3 |
| C、△H1=△H2=△H3 |
| D、△H1=△H3>△H2 |
下列离子方程式中正确的是( )
| A、稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
| B、用小苏打治疗胃酸过多:HCO3-+H+═H2O+CO2↑ |
| C、硝酸滴在石灰石上:CaCO3+2H+═Ca2++H2CO3 |
| D、醋酸钠和盐酸混和:CH3COONa+H+═CH3COOH+Na+ |