题目内容
强酸与强碱的稀溶液发生中和反应的反应为H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1,分别向1L 0.5mol?L-1的NaOH溶液中加入:①稀盐酸,②浓硫酸,③稀硝酸.恰好完全反应的反应热分别为△H1、△H2、△H3,它们之间的关系正确的是( )
| A、△H1>△H2>△H3 |
| B、△H2<△H1<△H3 |
| C、△H1=△H2=△H3 |
| D、△H1=△H3>△H2 |
考点:反应热的大小比较
专题:化学反应中的能量变化
分析:25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,弱电解质电离吸热,浓硫酸溶于水放热.
解答:
解:强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)═H2O△H=-57.3kJ/mol,表示稀溶液氢离子和氢氧根离子之间反应生成1mol水放出的热量为57.3kJ,分别向1L 0.5mol?L-1的NaOH溶液中加入
①稀盐酸,是稀溶液间的中和反应,放热
kJ,
②浓硫酸,浓硫酸溶于水放热,所以放热>
kJ,
③稀硝酸,是稀溶液间的中和反应,放热
kJ,
放出的热量为:②>③=①,因放热△H<0,所以△H1=△H3>△H2,
故选D.
①稀盐酸,是稀溶液间的中和反应,放热
| 57.3 |
| 2 |
②浓硫酸,浓硫酸溶于水放热,所以放热>
| 57.3 |
| 2 |
③稀硝酸,是稀溶液间的中和反应,放热
| 57.3 |
| 2 |
放出的热量为:②>③=①,因放热△H<0,所以△H1=△H3>△H2,
故选D.
点评:本题考查中和热,明确中和热的概念及弱电解质的电离、浓硫酸溶于水的热效应是解答的关键,题目难度不大.

练习册系列答案
相关题目
已知:
以下说法正确的是( )
| 共价键 | C-C | C=C | C-H | H-H | O=O |
| 键能/kJ?mol-1 | 348 | 610 | 413 | 436 | 496 |
| A、可计算氢气的燃烧热 |
| B、C=C比C-C化学性质更稳定 |
| C、C3H8(g)→CH3CH=CH2(g)+H2(g)△H=+128kJ/mol |
D、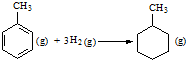 △H=-384kJ?mol-1 △H=-384kJ?mol-1 |
常温下,对pH=10的NaHCO3溶液中,各微粒的物质的量浓度分析正确的是( )
| A、c(CO32-)>c(H2CO3) |
| B、c(Na+)>c(HCO3-)>c(H+)>c(OH-) |
| C、c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
| D、c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
反应N2+3H2═2NH3+Q(Q>0),决定该反应速率的最主要因素是( )
| A、N2、H2的性质 |
| B、温度 |
| C、压强 |
| D、催化剂 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、由水电离产生的c(H+)=10-12mol/L的溶液:Na+、K+、NO3-、SO42- |
| B、明矾溶液:K+、C1-、S2-、OH- |
| C、pH=1的溶液:Ag(NH3)2+、Fe3+、ClO4-、NO3- |
| D、能溶解Al2O3的溶液:Na+、Mg2+、HCO3-、SO42- |
下列离子方程式中,不正确的是( )
| A、将氯气溶于水:Cl2+H2O═2H++Cl-+ClO- |
| B、AlCl3溶液中加入过量氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+ |
| C、FeBr2溶液中通入过量的Cl2:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
| D、向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
 3-甲基香豆素有香草味,可用于香料及化妆品,其结构简式如图所示.关于它的说法正确的是( )
3-甲基香豆素有香草味,可用于香料及化妆品,其结构简式如图所示.关于它的说法正确的是( )| A、分子式为C10H10O2 |
| B、分子中所有原子可能在同一平面上 |
| C、1mol该有机物与Br2的CCl4溶液发生加成反应,可以消耗5mol Br2 |
| D、1mol该有机物与NaOH溶液反应,可以消耗2mol NaOH |
下列反应中,属于取代反应的是( )
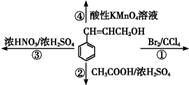

| A、①② | B、②③ | C、③④ | D、①④ |
有关能源的说法不正确的是( )
| A、煤、石油、天然气均为化石燃料 |
| B、化石能源是非再生能源 |
| C、氢能是可再生能源 |
| D、氢能、核能均是无污染的高效能源 |