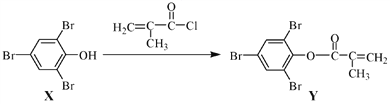
题目内容
【题目】下列关于离子方程式的评价正确的是
选项 | 离子方程式 | 评价 |
A | 将1molCl2通入到含2molFeI2的溶液中:2Fe2++Cl2==2Fe3++2Cl- | 正确;Fe2+的还原性强于I- |
B | 用惰性电极电解MgCl2溶液:2Cl-+2H2O | 错误;应生成Mg(OH)2沉淀 |
C | 过量SO2通入到NaClO溶液中:SO2+H2O+ClO-===HClO+HSO3- | 正确;H2SO3的酸性强于HClO |
D | Mg(HCO3)2溶液与足量的NaOH溶液反应:Mg2++2HCO3-+2OH-===MgCO3↓+2H2O | 正确;MgCO3比Mg(OH)2更难溶 |
A.AB.BC.CD.D
【答案】B
【解析】
A.I-的还原性强于Fe2+,所以正确的离子方程式为:![]() ,A项错误;
,A项错误;
B.惰性电极电解氯化镁溶液时,Cl-被氧化成Cl2,水电离的H+被还原为H2,同时Mg2+与电解过程中生成的OH-反应,生成沉淀,B项正确;
C.向NaClO溶液中通SO2会发生氧化还原反应,SO2被氧化生成![]() ,ClO-被还原为Cl-,C项错误;
,ClO-被还原为Cl-,C项错误;
D.Mg(OH)2比MgCO3更难溶,因此Mg(HCO3)2溶液与足量的NaOH反应,最终生成Mg(OH)2沉淀,D项错误;
答案选B。

【题目】温度T℃时,在3个体积相同的恒容密闭容器中发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g)ΔH=-41kJ·mol-1,其起始时投料、各物质的量及其达平衡过程体系热量的变化如表所示:
CO2(g)+H2(g)ΔH=-41kJ·mol-1,其起始时投料、各物质的量及其达平衡过程体系热量的变化如表所示:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系热量的变化(均为正值) | |||
CO | H2O(g) | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 32.8kJ |
② | 8 | 2 | 0 | 0 | Q1 |
③ | 0 | 0 | 1 | 4 | Q2 |
下列说法中不正确的是
A.容器②中热量变化:Q1=65.6kJ
B.平衡后容器①②中各组分体积分数相同
C.三个容器达平衡时,①中的CO、②中的H2O(g)、③中的CO2的转化率相等
D.保持相同条件,向平衡后的容器①中再加入0.1molCO和0.4molCO2(g),平衡不移动