题目内容
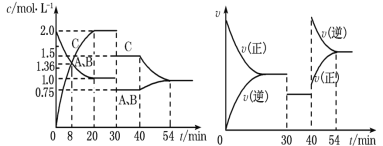
【题目】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)2C(g),达到平衡后,在不同的时间段,分别改变反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如图所示:
下列说法中正确的是( )
A.30min~40min间该反应使用了催化剂
B.反应方程式中的x=1,正反应为吸热反应
C.30min时降低温度,40min时升高温度
D.8min前A的平均反应速率为0.08mol·L-1·min-1
【答案】D
【解析】
A.由图象可知,30~40 min只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,故A错误;
B.由开始到达到平衡,A、B的浓度减少的量相同,由此可知x=1,反应前后气体体积不变,则增大压强平衡不移动,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡逆向移动,应是升高温度,则正反应为放热反应,故B错误;
C.由图象可知,30min时只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,故C错误;
D.由图可知8min前A的浓度减小了2molL-1-1.36molL-1=0.64molL-1,所以A的反应速率为![]() =0.08molL-1min-1,故D正确;
=0.08molL-1min-1,故D正确;
答案选D。

【题目】依据下列信息,完成填空:
(1)某单质位于短周期,是一种常见的半导体材料。在25℃、101kPa下,其气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移1mol电子放热190.0kJ,该反应的热化学方程式是___。
(2)已知:2Zn(s)+O2(g)=2ZnO(s) ΔH=-701.0kJ·mol-1,2Hg(l)+O2(g)=2HgO(s) ΔH=-181.6kJ·mol-1,则反应: Zn(s)+HgO(s)=ZnO(s)+Hg(l)的ΔH为___。
(3)在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表:
化学方程式 | K(t1) | K(t2) |
F2+H22HF | 1.8×1036 | 1.9×1032 |
Cl2+H22HCl | 9.7×1012 | 4.2×1011 |
Br2+H22HBr | 5.6×107 | 9.3×106 |
I2+H22HI | 43 | 34 |
①已知t2>t1,生成HX的反应是___反应(填“吸热”或“放热”)。
②K的变化体现出X2化学性质的递变性,用原子结构解释原因:___,原子半径逐渐增大,得电子能力逐渐减弱。
③在t1温度1L恒容密闭容器中,1molI2(g)和1molH2反应达平衡时热量变化值为Q1;反之,2molHI分解达平衡时热量变化值为Q2,则:Q1___Q2(填“>”“<”“=”)。