题目内容
【题目】依据下列信息,完成填空:
(1)某单质位于短周期,是一种常见的半导体材料。在25℃、101kPa下,其气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移1mol电子放热190.0kJ,该反应的热化学方程式是___。
(2)已知:2Zn(s)+O2(g)=2ZnO(s) ΔH=-701.0kJ·mol-1,2Hg(l)+O2(g)=2HgO(s) ΔH=-181.6kJ·mol-1,则反应: Zn(s)+HgO(s)=ZnO(s)+Hg(l)的ΔH为___。
(3)在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表:
化学方程式 | K(t1) | K(t2) |
F2+H22HF | 1.8×1036 | 1.9×1032 |
Cl2+H22HCl | 9.7×1012 | 4.2×1011 |
Br2+H22HBr | 5.6×107 | 9.3×106 |
I2+H22HI | 43 | 34 |
①已知t2>t1,生成HX的反应是___反应(填“吸热”或“放热”)。
②K的变化体现出X2化学性质的递变性,用原子结构解释原因:___,原子半径逐渐增大,得电子能力逐渐减弱。
③在t1温度1L恒容密闭容器中,1molI2(g)和1molH2反应达平衡时热量变化值为Q1;反之,2molHI分解达平衡时热量变化值为Q2,则:Q1___Q2(填“>”“<”“=”)。
【答案】SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) ΔH=-1520.0kJ·mol-1 -259.7kJ·mol-1 放热 同一主族元素从上到下原子核外电子层数依次增多 >
【解析】
(1)某单质位于短周期,是一种常见的半导体材料,该元素为硅,根据题意发生反应为SiH4+2O2═SiO2+2H2O,根据反应,1mol SiH4参与反应时转移8mole,据此计算书写热化学方程式;
(2)根据盖斯定律计算;
(3)①温度升高,平衡常数减小,说明平衡向逆反应方向移动,HX的生成反应为放热反应;
②平衡常数越大,说明反应越易进行,F、Cl、Br、I的得电子能力依次减小的主要原因是:同一主族元素从上到下原子核外电子层数依次增多,原子半径逐渐增大,核对最外层电子的吸引力依次减弱;
③由于HX的生成反应为放热反应,则HX的分解反应为吸热反应。
(1)某单质位于短周期,是一种常见的半导体材料,该元素为硅,根据题意发生反应为SiH4+2O2═SiO2+2H2O,根据反应,1mol SiH4参与反应时转移8mole,所以,当有1molSiH4参加反应时,放出热量为190.0kJ×8=1520.0kJ,其热反应方程式为:SiH4(g)+2O2(g)═SiO2(s)+2H2O(l)△H=1520.0kJmol1;
(2)已知:①2Zn(s)+O2(g)=2ZnO(s) ΔH=-701.0kJ·mol-1
②2Hg(l)+O2(g)=2HgO(s) ΔH=-181.6kJ·mol-1,
根据盖斯定律,![]() ×(①-②)可得:Zn(s)+HgO(s)=ZnO(s)+Hg(l)ΔH=-259.7kJ·mol-1;
×(①-②)可得:Zn(s)+HgO(s)=ZnO(s)+Hg(l)ΔH=-259.7kJ·mol-1;
(3)①由表中数据可知,温度越高平衡常数越小,这说明升高温度平衡向逆反应方向移动,所以HX的生成反应是放热反应;
②平衡常数越大,说明反应越易进行,F、Cl、Br、I的得电子能力依次减小的主要原因是:同一主族元素从上到下原子核外电子层数依次增多,原子半径逐渐增大,核对最外层电子的吸引力依次减弱造成的;
③在t1温度1L恒容密闭容器中,1molI2(g)和1molH2反应达平衡时,设I2的转化浓度为x,列三段式:
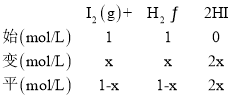
K= =43,解得x=
=43,解得x=![]() ,则I2的转化率=
,则I2的转化率=![]() ×100%≈76.7%,即1molI2(g)和1molH2反应达平衡时的转化率为76.7%,由于在t1温度1L恒容密闭容器中,1molI2(g)和1molH2反应与2molHI分解反应互为等效平衡,两个反应的转化率之和等于1,则2molHI分解达平衡时HI的转化率=1-76.7%=23.3%,转化的量越多,平衡时热量变化值越大,则Q1>Q2。
×100%≈76.7%,即1molI2(g)和1molH2反应达平衡时的转化率为76.7%,由于在t1温度1L恒容密闭容器中,1molI2(g)和1molH2反应与2molHI分解反应互为等效平衡,两个反应的转化率之和等于1,则2molHI分解达平衡时HI的转化率=1-76.7%=23.3%,转化的量越多,平衡时热量变化值越大,则Q1>Q2。