题目内容
6.设计两种实验方案来鉴别溴蒸汽和二氧化氮气体.写出实验方案、实验现象.方案一:加水振荡,气体颜色褪去,溶液呈无色的为NO2气体,溶液呈红棕色的为溴蒸汽
方案二:加入AgNO3溶液振荡,生成黄色沉淀的是溴蒸汽,溶液仍为无色的是NO2.
分析 溴蒸汽和二氧化氮气体均为红棕色气体,二氧化氮与水反应得到无色溶液,而溴水有颜色;且二氧化氮与硝酸银溶液混合不生成沉淀,但溴水与硝酸银反应生成AgBr沉淀,以此来解答.
解答 解:鉴别溴蒸汽和二氧化氮气体,方法为(1)加水振荡,气体颜色褪去,溶液呈无色的为NO2气体,溶液呈红棕色的为溴蒸汽;
(2)加入AgNO3溶液振荡,生成黄色沉淀的是溴蒸汽,溶液仍为无色的是NO2,
故答案为:加水振荡,气体颜色褪去,溶液呈无色的为NO2气体,溶液呈红棕色的为溴蒸汽;加入AgNO3溶液振荡,生成黄色沉淀的是溴蒸汽,溶液仍为无色的是NO2.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、性质差异为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
16.异秦皮啶具有镇静安神抗肿瘤功效,秦皮素具有抗痢疾杆菌功效.它们在一定条件下可发生转化,如图所示,有关说法正确的是( )


| A. | 异秦皮啶与秦皮素互为同系物 | |
| B. | 异秦皮啶分子式为C11H12O5 | |
| C. | 秦皮素一定条件下能发生加成反应、消除反应和取代反应 | |
| D. | 1mol秦皮素最多可与2molBr2、4molNaOH反应 |
14.溴又称为海洋元素,主要用作制溴化物,并用于医药、农药、染料、香料、摄影材料、灭火剂、选矿、冶金、鞣革、净水等,部分用作普通分析试剂和有机合成剂.从海水中可以提取溴,主要反应之一为2NaBr+Cl2═2NaCl+Br2,下列说法中正确的是( )
| A. | 溴离子具有氧化性 | B. | 氯气是还原剂 | ||
| C. | 该反应属于复分解反应 | D. | 氯气氧化性比溴单质的强 |
1.已知在酸性条件下有以下反应关系KBrO3 能将KI氧化成I2 或KIO3,其本身被还原为Br2,Br2 能将I-氧化为I2;KIO3 能将 I- 氧化为I2,也能将Br-氧化成Br2,其本身被还原为I2.现向含有1mol KI的硫酸溶液中加入含a mol KBrO3的溶液,a的取值不同,所得产物也不同.
(1)试将讨论的结果填入表中:
(2)此表编号③中,当 n(I2)=n(IO3-) 时,a 的值为$\frac{8}{15}$.
(1)试将讨论的结果填入表中:
| 编 号 | а取值范围 | 产物化学式(离子符号) |
| ① | I2、Br- | |
| ② | $\frac{1}{6}$<а<1/5 | |
| ③ | I2、IO3-、Br2 | |
| ④ |
15.下列溶液关于各微粒浓度的判断正确的是( )
| A. | 常温下向10mlPH=12的NaOH溶液中加入PH=2的HA至PH=7所得的溶液的总体积V≧20ml | |
| B. | 在做中和滴定实验时向滴有酚酞的NaOH溶液中滴加盐酸至溶液恰好无色,此时溶液PH<7 | |
| C. | 肥田粉溶于水所得溶液中C(NH4+)>C(SO42-)>C(H+)>C(OH-) | |
| D. | PH>7的草酸钾溶液中C(OH-)-C(H+)=4 C(H2C2O4)+2 C(HC2O4-)+2 C(C2O42-)-C(K+) |
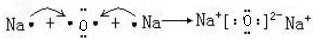


 →
→ .
.
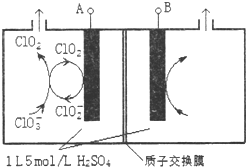 二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.
二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.