题目内容
在某温度下,将H2和I2各0.10mol的气态混合物充入l0L的密闭容器中,充分反应,达到平衡后,测得c(H2)=0.0080mol/L。则,氢气的转化率为 ;该温度下,反应的平衡常数为 ;已知该反应为放热反应,当降低温度时,反应的平衡常数会 (填“变大”、“变小”或“不变”)。
( 6分) 20﹪ 0.25 变大 (各2分)
试题分析:该反应的化学方程式是H2 + I2
 2HI
2HI起始浓度(mol/L) 0.01 0.01 0
转化浓度(mol/L) 0.002 0.002 0.004
平衡浓度(mol/L) 0.008 0.008 0.004
所以氢气的转化率是
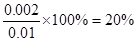
该温度下,反应的平衡常数为

正反应是放热反应,则降低温度,平衡向正反应方向移动,平衡常数变大。
点评:该题是中等难度的试题,该题也是高考中的重要考点和题型。该题基础性强,侧重能力的培养和解题方法的指导与训练,有助于培养学生的规范答题能力和逻辑推理能力。

练习册系列答案
相关题目
 xC(g) △H>0,达到化学平衡后,C的体积分数为a。
xC(g) △H>0,达到化学平衡后,C的体积分数为a。 C(g)+D(g)已达平衡的是
C(g)+D(g)已达平衡的是  2CO2 + N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
2CO2 + N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
 CO(NH2)2(l) + H2O (l) ΔH < 0 。回答下列问题:
CO(NH2)2(l) + H2O (l) ΔH < 0 。回答下列问题: NH2COONH4(s) ΔH1< 0
NH2COONH4(s) ΔH1< 0 CO(NH2)2(l)+ H2O (l) ΔH 2> 0
CO(NH2)2(l)+ H2O (l) ΔH 2> 0

 4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
 2Z(g);若X、Y、Z起始浓度分别为C1、C2、C3(均不为0),平衡时X、Y、Z的浓度分别为0.1mol/L、0.3 mol/L、0.08 mol/L,则下列判断不合理的是
2Z(g);若X、Y、Z起始浓度分别为C1、C2、C3(均不为0),平衡时X、Y、Z的浓度分别为0.1mol/L、0.3 mol/L、0.08 mol/L,则下列判断不合理的是 
 2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的是
2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的是 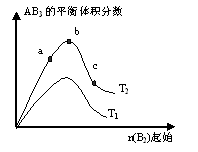
 cC(g)+dD(g),达到平衡后将气体体积压缩到原来的一半,当再次达到新平衡时,D的浓度为原来的1.8倍,下列说法正确的是 ( )
cC(g)+dD(g),达到平衡后将气体体积压缩到原来的一半,当再次达到新平衡时,D的浓度为原来的1.8倍,下列说法正确的是 ( )