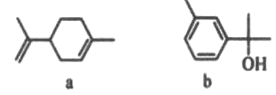��Ŀ����
����Ŀ������ѧһѡ��3:���ʽṹ�����ʡ������ꡢ���Ƚ������仯�����ڿ�ѧ�о���ҵ������Ӧ��ʮ�ֹ㷺���ش���������:
(1)��̬��ԭ�ӵļ۵����Ų�ʽΪ________�������ܡ����Ļ�̬ԭ�Ӻ���δ�ɶԵ��������ٵ���_____________
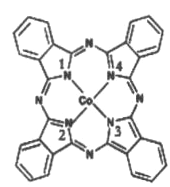
(2)̪ݼ�ܷ��ӵĽṹ��ʽ��ͼ��ʾ,��������Ϊ������,̪�ܷ�������������ͨ����λ����ϵĵ�ԭ�ӵı����__________ (��1��2��3��4)�����ַǽ���ԭ�ӵĵ縺���ɴ�С��˳��Ϊ____(����Ӧ��Ԫ�ط��ű�ʾ);̼ԭ�ӵ��ӻ��������Ϊ_________
(3)Fe(CO)x�����³�Һ̬,�۵�Ϊ-20.5��,�е�Ϊ103��,�����ڷǼ����ܼ�,�ݴ˿��ж�Fe(CO) x��������_______ (�������),�������Fe(CO) x������ԭ�Ӽ۵������������ṩ������֮��Ϊ18,��x=_________
(4)NiO��FeO�ľ���ṹ�������Ȼ��Ƶ���ͬ,Ni2+��Fe2+�����Ӱ뾶�ֱ�Ϊ69pm��78pm,���۵�NiO ______ FeO(�>����<����=��),ԭ����___________________________��
(5)NiAs�ľ����ṹ��ͼ��ʾ:
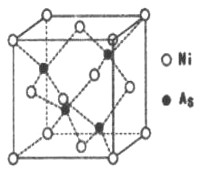
�������ӵ���λ��Ϊ_________��
���������ӵ�������ֵΪNA,�����ܶ�Ϊpg.cm-1,��þ��������������֮��ľ���Ϊ_____cm��(д���������ʽ)
���𰸡� 3d74s2 �� 2��4 N>C>H sp2 ���Ӿ��� 5 �� ��ͬ��ɵ����ӣ��뾶ԽС�����Ӽ�ľ���������Խ�����Ӿ���ľ�����Խ�� 4 ![]() ����536/NA��p cm
����536/NA��p cm
����������1��CoΪ27��Ԫ�أ�ԭ�Ӻ��������Ϊ27�������������ԭ�������������Ų�ʽΪ:![]() ����ԭ�ӵļ۵����Ų�ʽΪ3d74s2�������ܡ�����ԭ�Ӻ�������Ų�Ϊ3d64s2 ��3d74s2 ��3d84s2����˺���δ�ɶԵ��������ٵ���������ȷ�𰸣�3d74s2 ������
����ԭ�ӵļ۵����Ų�ʽΪ3d74s2�������ܡ�����ԭ�Ӻ�������Ų�Ϊ3d64s2 ��3d74s2 ��3d84s2����˺���δ�ɶԵ��������ٵ���������ȷ�𰸣�3d74s2 ������
��2����ͼ�п�֪��̪�ܷ�������������ͨ����λ����ϵĵ�ԭ�ӵı����2��4��̪ݼ�������ַǽ���ԭ��ΪC��N��H,ͬ����������ҵ縺������,�ǽ�����Խǿ�縺��Խ��,�ʵ縺��N>C>H ��������Cԭ�Ӿ��γ�3��![]() ��,û�й¶Ե���,�ӻ������ĿΪ3,̼ԭ�ӵ��ӻ��������Ϊ
��,û�й¶Ե���,�ӻ������ĿΪ3,̼ԭ�ӵ��ӻ��������Ϊ![]() ����ȷ�𰸣� 2��4 �� N>C>H�� sp2 ��
����ȷ�𰸣� 2��4 �� N>C>H�� sp2 ��
(3)���Ӿ�����۷е�ϵ������������Ϣ֪�������ʵ��۷е�ϵ�������Ϊ���Ӿ����������![]() ������ԭ������ԭ������۵�������8��ÿ�������ṩ�ĵ�������2��
������ԭ������ԭ������۵�������8��ÿ�������ṩ�ĵ�������2��![]() ��
��![]() ����ȷ�𰸣����Ӿ��壻5 ��
����ȷ�𰸣����Ӿ��壻5 ��
��4��![]() ��
��![]() �ľ���ṹ���;����Ȼ��Ƶ���ͬ,˵�����߶������Ӿ��������Ӿ�����۵������Ӽ���ǿ���й��� ��ͬ��ɵ����ӣ��뾶ԽС�����Ӽ�ľ���������Խ�����Ӿ���ľ�����Խ���۵�Խ�ߣ� ��Ϊ
�ľ���ṹ���;����Ȼ��Ƶ���ͬ,˵�����߶������Ӿ��������Ӿ�����۵������Ӽ���ǿ���й��� ��ͬ��ɵ����ӣ��뾶ԽС�����Ӽ�ľ���������Խ�����Ӿ���ľ�����Խ���۵�Խ�ߣ� ��Ϊ![]() �����Ӱ뾶С��
�����Ӱ뾶С��![]() �����Ӱ뾶�������۵���
�����Ӱ뾶�������۵���![]() ����ȷ�𰸣�����ͬ��ɵ����ӣ��뾶ԽС�����Ӽ�ľ���������Խ�����Ӿ���ľ�����Խ���۵�Խ�ߡ�
����ȷ�𰸣�����ͬ��ɵ����ӣ��뾶ԽС�����Ӽ�ľ���������Խ�����Ӿ���ľ�����Խ���۵�Խ�ߡ�
��5����������ԭ����ĿΪ![]() ����ԭ����ĿΪ4������������Ϊ4����59+75��/NAg, �������=4����59+75��/NA��p=536/ NA��pcm3�����ⳤr=
����ԭ����ĿΪ4������������Ϊ4����59+75��/NAg, �������=4����59+75��/NA��p=536/ NA��pcm3�����ⳤr= ![]() ����ԭ������Χ��4����ԭ���γ���������ṹ����ԭ�����������嶥�����ľ����������ԭ������ԭ�����ߴ��ھ�����Խ���������Ϊ��Խ��߳��ȵ�
����ԭ������Χ��4����ԭ���γ���������ṹ����ԭ�����������嶥�����ľ����������ԭ������ԭ�����ߴ��ھ�����Խ���������Ϊ��Խ��߳��ȵ�![]() �����ھ����ⳤ��
�����ھ����ⳤ��![]() r�����������������Ϊ
r�����������������Ϊ![]() ��
��![]() ;��ȷ�𰸣�
;��ȷ�𰸣� ![]() ��
��![]() ��
��

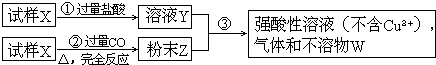
����Ŀ��ij���Թ�ҵ��ˮ�к���K2Cr2O7 �� �����£����ᣨH2C2O4���ܽ����е�Cr2O72��ת��ΪCr3+ �� ij�������о����֣�����������[Al2Fe��SO4��424H2O]���ɶԸ÷�Ӧ������ã�Ϊ��һ���о��й����ضԸ÷�Ӧ���ʵ�Ӱ�죬̽�����£�
��1����25���£����ƹ���ǿ�ȡ���ˮ��Ʒ��ʼŨ�Ⱥʹ���������ͬ�����ڲ�ͬ�ij�ʼpH��һ��Ũ�Ȳ�����Һ���������Ա�ʵ�飬�������ʵ����Ʊ�
ʵ���� | ��ʼpH | ��ˮ��Ʒ���/mL | ������Һ���/mL | ����ˮ���/mL |
�� | 4 | 60 | 10 | 30 |
�� | 5 | 60 | 10 | 30 |
�� | 5 | 60 |
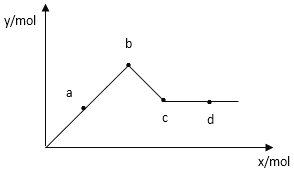
���ʵ��ٺ͢���Һ�е�Cr2O72��Ũ����ʱ��仯��ϵ��ͼ��ʾ��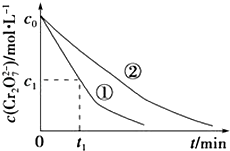
��2��������Ӧ����ᱻ���������ӷ���ʽΪ
��3��ʵ��ٺ͢ڵĽ��������ʵ�����0��t1ʱ��η�Ӧ����v��Cr3+��=molL��1min��1���ô���ʽ��ʾ����
��4���ÿ������������[Al2Fe��SO4��424H2O]��������õijɷ�������¼��裬������ɼ�����ͼ������� ����һ��Fe2+������ã�
���������
����������
��5���������ʵ����֤��������һ������±������ݣ� ����������ʵ���ṩ���Լ��⣬�ɹ�ѡ���ҩƷ��K2SO4��FeSO4��K2SO4Al2��SO4��324H2O��Al2��SO4��3�ȣ���Һ��Cr2O72����Ũ�ȿ��������ⶨ��
ʵ�鷽������Ҫ��д����������̣� | Ԥ��ʵ�����ͽ��� |