题目内容
【题目】对1 mol N2和1 mol CO2进行比较,下列说法不正确的是
A.分子数一定相同 B.原子数一定不相同
C.体积一定相同 D.质量一定不相同
【答案】C
【解析】
试题分析:1 mol N2分子数为NA,原子数为2NA,标准状况下体积为22.4L,质量为28g;1 mol CO2分子数为NA,原子数为3NA,标准状况下体积为22.4L,质量为44g;则分子数相同,原子数不相同,体积只有在标准状况下才相同,质量不相同,答案选C。

 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案【题目】钒是一种重要的合金元素,还用于催化剂和新型电池。从含钒固体废弃物(含有SiO2、Al2O3及其他残渣)中提取钒的一种新工艺主要流程如下:
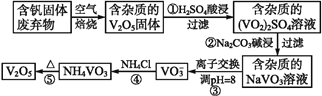
部分含钒化合物在水中的溶解性如下表:
物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
请回答下列问题:
(1)反应①所得溶液中除H+之外的阳离子有______。
(2)反应②碱浸后滤出的固体主要成分是______(写化学式)。
(3)反应④的离子方程式为__________。
(4)25 ℃、101 kPa时,4Al(s)+3O2(g)![]() 2Al2O3(s) ΔH1= —a kJ·mol-1,4V(s)+5O2(g)
2Al2O3(s) ΔH1= —a kJ·mol-1,4V(s)+5O2(g)![]() 2V2O5(s) ΔH2=—b kJ·mol-1。用V2O5发生铝热反应冶炼金属钒的热化学方程式是___________。
2V2O5(s) ΔH2=—b kJ·mol-1。用V2O5发生铝热反应冶炼金属钒的热化学方程式是___________。
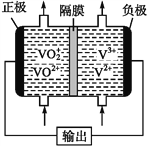
(5)钒液流电池(如下图所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过。电池放电时负极的电极反应式为_______,电池充电时阳极的电极反应式是________。
【题目】合成氨是基本无机化工,氨是化肥工业和有机化工的主要原料,也是一种常用的制冷剂.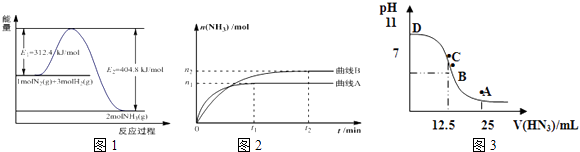
(1)图1是合成氨反应的能量与反应过程相关图(未使用催化剂);图2是合成氨反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图.①下列说法正确的是 .
A.使用催化剂会使E1的数值增大
B.△H=﹣92.4kJmol﹣1
C.为了提高转化率,工业生产中反应的温度越低越好
D.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为 ![]() molL﹣1min﹣1
molL﹣1min﹣1
E.该反应的平衡常数KA<KB
F.图2是不同压强下反应体系中氨的物质的量与反应时间关系图,且PA<PB
②下列能说明该反应达到平衡状态的是
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.v正(N2)=v逆(H2)
C.混合气体的密度保持不变
D.容器内压强保持不变
(2)合成氨技术的创立开辟了人工固氮的重要途径,合成氨反应的平衡常数K值和温度的关系如下:
温度/℃ | 200 | 300 | 400 |
K | 1.0 | 0.86 | 0.5 |
400°C时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3molL﹣1、2molL﹣1、1molL﹣1时,此时刻该反应的v逆(N2)v正(N2) (填“>”、“<”或“=”).
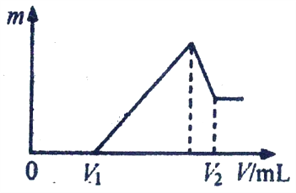
(3)常温下向25mL0.1mol/LNH3H2O 溶液中,逐滴加入 0.2mol/L的HN3溶液,溶液的pH变化曲线如图3所示.A、B、C、D四个点中,水的电离程度最大的是;A点时溶液中各离子浓度由小到大的顺序为 .
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl﹣NH4Cl为电解质溶液制造新型燃料电池.试写出该电池的正极反应式 .
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、NO2- 等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2 + CO ![]() CO2 + NO 该反应的平衡常数为K1(下同)
CO2 + NO 该反应的平衡常数为K1(下同)
每1mol下列物质分解为气态基态原子消耗能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol K2
2NO(g) ΔH=+179.5 kJ/mol K2
③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol K3
2NO2(g) ΔH=-112.3 kJ/mol K3
试写出NO与CO反应生成无污染物气体的热化学方程式____________________________以及此热化学方程式的平衡常数K=____________(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO![]() 4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的![]() ,则反应开始到平衡时CO的平均反应速率v(CO)=________。
,则反应开始到平衡时CO的平均反应速率v(CO)=________。
若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围________________。
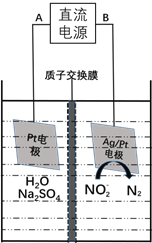
(3)电化学降解NO2-的原理如下图:
①电源的负极是____________(填A或B)阴极反应式为________________。
②若电解过程中转移了6mol电子,则膜两侧电解液的质量变化差![]() 为_____g。
为_____g。