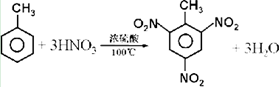
题目内容
10.现有短周期元素X、Y、Z、M,X、Y位于同主族,Z、M位于同主族,Y、Z位于同周期,X与Z、M都不在同一周期,Z的核电荷数是M的2倍.下列说法正确的是( )| A. | 简单阳离子的氧化性:Y>X | |
| B. | 气态氢化物的稳定性:Z>M | |
| C. | 简单离子半径由大到小的顺序是:Z>M>Y | |
| D. | X2Z与X2M比较,稳定性:X2Z>X2M |
分析 X、Y、Z、M四种短周期元素,Z、M位于同主族,Z的核电荷数是M的2倍,可推知Z为S元素、M为O元素;Y、Z位于同周期,即处于第三周期,X与Z、M都不在同一周期,则X处于第一周期,可推知X为H元素,X、Y位于同主族,则Y为Na,据此解答.
解答 解:X、Y、Z、M四种短周期元素,Z、M位于同主族,Z的核电荷数是M的2倍,可推知Z为S元素、M为O元素;Y、Z位于同周期,即处于第三周期,X与Z、M都不在同一周期,则X处于第一周期,可推知X为H元素,X、Y位于同主族,则Y为Na.
A.X为H元素,Y为Na,元素的金属性越强,其简单阳离子的氧化性越弱,金属性Na的强,所以阳离子氧化性:Na+<H+,故A错误;
B.Z为S元素、M为O元素,非金属性O>S,故氢化物稳定性H2O>H2S,故B错误;
C.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2->O2->Na+,故C正确;
D.X2Z与X2M分别为H2S、H2O,非金属性O>S,故氢化物稳定性H2O>H2S,故D错误,
故选C.
点评 本题考查结构性质位置关系应用,“Z、M位于同主族,Z的核电荷数是M的2倍”是推断突破口,难度不大,注意元素周期律的灵活运用.

练习册系列答案
相关题目
20.温度一定时,用水稀释0.1mol•L-1氨水时,随着水量的增加而减小的是( )
| A. | $\frac{c(O{H}^{-})•c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$ | B. | $\frac{c(N{H}_{3}•{H}_{2}O)}{c(O{H}^{-})}$ | ||
| C. | c(H+)和c(OH-)的乘积 | D. | OH-的物质的量 |
1.在下列能级中,所含的原子轨道数最大的是( )
| A. | 3d | B. | 5f | C. | 6p | D. | 7s |
18.下列事实不能用有机物分子内基团间的相互作用解释的是( )
| A. | 苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应 | |
| B. | 乙烯能发生加成反应,乙烷不能发生加成反应 | |
| C. | 甲苯能使高锰酸钾酸性溶液褪色,甲烷和苯不能使高锰酸钾酸性溶液褪色 | |
| D. | 苯与硝酸在50~60°C发生取代反应,甲苯与硝酸在30°C就能发生取代反应 |
15.在密闭容器中发生如下反应:mA(g)+nB(g)═pC(g)达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来的1.9倍.下列说法中正确的是( )
| A. | m+n<p | B. | 平衡向正反应方向移动 | ||
| C. | A的转化率降低 | D. | C的体积分数增加 |
2. X、Y、Z、Q均为短周期元素,它们在周期表中相对位置如图所示.若X原子的最外层电子是内层电子数的2倍.下列说法中,正确的是( )
X、Y、Z、Q均为短周期元素,它们在周期表中相对位置如图所示.若X原子的最外层电子是内层电子数的2倍.下列说法中,正确的是( )
 X、Y、Z、Q均为短周期元素,它们在周期表中相对位置如图所示.若X原子的最外层电子是内层电子数的2倍.下列说法中,正确的是( )
X、Y、Z、Q均为短周期元素,它们在周期表中相对位置如图所示.若X原子的最外层电子是内层电子数的2倍.下列说法中,正确的是( )| A. | X与Q形成的化合物中含有共价键 | |
| B. | 最高价氧化物对应水化物的酸性:Q比Z弱 | |
| C. | 14X和14Y具有相同的质量数,互为同位素 | |
| D. | Q与O2反应生成的化合物中,Q元素显+6价 |
19.钾元素的核素${\;}_{19}^{39}$K中,中子数与质子数之差为( )
| A. | 1 | B. | 19 | C. | 20 | D. | 39 |
20.对于任意反应,决定化学反应速率的最主要因素是( )
| A. | 反应物浓度 | B. | 温度 | C. | 压强 | D. | 反应物本身性质 |