题目内容
12.A是一种含碳、氢、氧三种元素的有机化合物.已知:A中碳的质量分数为44.1%,氢的质量分数为8.82%;A只含一种官能团,且每个碳原子上最多只连一个官能团;A能与乙酸发生酯化反应,但不能在两个相邻碳原子上发生消去反应.通过计算求:(1)A的分子式是C5H12O4,其结构简式是C(CH2OH)4.
(2)27.2gA在空气中充分燃烧时生成的CO2用170ml 10mol/L的NaOH溶液吸收,反应后溶液中溶质的成分是Na2CO3和NaHCO3,其物质的量是0.7mol碳酸钠、0.3mol碳酸氢钠.
分析 (1)A中碳的质量分数为44.1%,氢的质量分数为8.82%,则A中氧的质量分数为:1-44.12%-8.82%=47.06%.由此可算出C:H:O≈5:12:4,分子式为C5H12O4,A只含有一种官能团,又能与乙酸发生酯化反应,该官能团必为羟基.但该羟基不能在两个相邻碳原子上发生消去反应,故邻位碳原子上应无氢原子,该分子中各原子已达到饱和,4个氧必为4个羟基,综上所述其结构为C(CH2OH)4;
(2)根据有机物A的燃烧通式计算出消耗氧气的物质的量,再根据A的物质的量计算出生成二氧化碳的物质的量,根据n=cV计算出氢氧化钠的物质的量,根据二氧化碳与氢氧化钠的物质的量之比判断反应后溶质的组成,再根据碳原子、钠原子守恒计算出各溶质的物质的量.
解答 解:(1)由于A中碳的质量分数为44.12%,氢的质量分数为8.82%,故A中氧的质量分数为1-44.12%-8.82%=47.06%,
则C:H:O=$\frac{44.1%}{12}$:$\frac{8.82%}{1}$:$\frac{47.06}{16}$≈5:12:4,则分子式为C5H12O4;
A只含有一种官能团,又能与乙酸发生酯化反应,该官能团必为羟基,但该羟基不能在两个相邻碳原子上发生消去反应,故邻位碳原子上应无氢原子,又该分子中各原子已达到饱和,4个氧必为4个羟基,则该有机物的结构简式为:C(CH2OH)4,
故答案为:C5H12O4;C(CH2OH)4;
(2)27.2gA的物质的量为:$\frac{27.2g}{136g/mol}$=0.2mol,0.2molA完全燃烧生成二氧化碳的物质的量为:0.2mol×5=1mol,
170ml 10mol/L的NaOH溶液中含有氢氧化钠的物质的量为:10mol/L×0.17L=1.7mol,
二氧化碳与氢氧化钠的物质的量为1:1.7,则生成产物为Na2CO3、NaHCO3的混合物,
设Na2CO3、NaHCO3的物质的量分别为x、y,根据碳原子、钠原子守恒可得:2x+y=1.7mol、x+y=1mol,
解得:x=0.7mol、y=0.3mol,
即混合物中含有0.7mol碳酸钠、0.3mol碳酸氢钠,
故答案为:Na2CO3和NaHCO3;0.7mol碳酸钠、0.3mol碳酸氢钠.
点评 本题考查了有机物分子式、结构简式的确定以及有机物官能团的结构与性质,题目难度中等,注意掌握确定有机物分子式的常用方法,(1)为易错点,注意结构简式的推断.

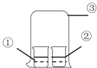
| ①中物质 | ②中物质 | 实验预测 | |
| A | 浓氨水 | 酚酞试液 | ②中溶液变为红色 |
| B | 浓硝酸 | 淀粉KI溶液 | ②中溶液变为蓝色 |
| C | 浓盐酸 | 浓氨水 | 大烧杯中有白烟 |
| D | 饱和的亚硫酸溶液 | 稀溴水 | ②中无明显变化 |
| A. | A | B. | B | C. | C | D. | D |
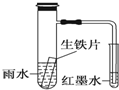
| A. | 生铁片中的碳是原电池的负极,发生还原反应 | |
| B. | 雨水酸性较强,生铁片始终发生析氢腐蚀 | |
| C. | 具支试管中溶液酸性增强 | |
| D. | 墨水回升时,碳电极反应式为O2+2H2O+4e-═4OH- |
| A. | $\frac{c(O{H}^{-})•c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$ | B. | $\frac{c(N{H}_{3}•{H}_{2}O)}{c(O{H}^{-})}$ | ||
| C. | c(H+)和c(OH-)的乘积 | D. | OH-的物质的量 |
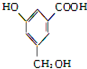 分别与NaHCO3、Na、NaOH反应消耗掉的三者的物质的量之比为( )
分别与NaHCO3、Na、NaOH反应消耗掉的三者的物质的量之比为( )| A. | 1:1:1 | B. | 1:3:2 | C. | 2:3:1 | D. | 1:2:3 |
| R | |||
| T | Q | W |
| A. | 原子半径:T>Q>R | |
| B. | 最简单气态氢化物的还原性:R>Q | |
| C. | 含T的盐溶液一定显酸性 | |
| D. | 最高价氧化物对应水化物的酸性:Q<W |
| A. | 3d | B. | 5f | C. | 6p | D. | 7s |
 X、Y、Z、Q均为短周期元素,它们在周期表中相对位置如图所示.若X原子的最外层电子是内层电子数的2倍.下列说法中,正确的是( )
X、Y、Z、Q均为短周期元素,它们在周期表中相对位置如图所示.若X原子的最外层电子是内层电子数的2倍.下列说法中,正确的是( )| A. | X与Q形成的化合物中含有共价键 | |
| B. | 最高价氧化物对应水化物的酸性:Q比Z弱 | |
| C. | 14X和14Y具有相同的质量数,互为同位素 | |
| D. | Q与O2反应生成的化合物中,Q元素显+6价 |
