题目内容
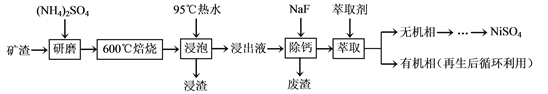
【题目】下面是工业上以含金、银、铂、铜的金属废料提取金、银、铂的工艺流程。

已知:溶液I中铂和金形成化合物为H[AuC14]和H2[PtCl6]。浓盐酸物质浓度:12mol/L,密度1.179g/cm3;浓硝酸质量分数约为65%,密度约为1.4g/cm3
(1)写出NH4C1的电子式______________。
(2)操作I中金属废料应该连接电源的____极,若另一极采用纯铜,该过程的工业名称为________________。
(3)依据信息和所学知识,王水配制的具体操作为_________________。
(4)通入SO2的作用是__________,SO2不能通入过量的原因是_____________。
(5)阳极泥与王水反应,硝酸被还原为NO,请写出其中一个反应的化学方程式______________。
(6)由银制备银-氯化银参比电极的工作原理如图所示。一段时间后与A连接的电极就会被氯化银覆盖,当乙池中产生0.2g气体时,甲池溶液质量变化为_________________。

【答案】 ![]() 正 粗铜的精炼 取一体积浓硝酸慢慢倒入到三体积浓盐酸中,不断用玻璃棒搅拌。 将金从溶液中还原出来 防止金属铂被还原 Au+HNO3+4HCl=H[AuCl4]+NO↑+2H2O(3Pt+4HNO3+18HCl=3H2[PtCl6]+4NO↑+8H2O,3Ag+HNO3+3HCl=3AgCl↓+NO↑+2H2O) 减少7.3g
正 粗铜的精炼 取一体积浓硝酸慢慢倒入到三体积浓盐酸中,不断用玻璃棒搅拌。 将金从溶液中还原出来 防止金属铂被还原 Au+HNO3+4HCl=H[AuCl4]+NO↑+2H2O(3Pt+4HNO3+18HCl=3H2[PtCl6]+4NO↑+8H2O,3Ag+HNO3+3HCl=3AgCl↓+NO↑+2H2O) 减少7.3g
【解析】(1)NH4C1是离子化合物,电子式为![]() 。(2)电解后产生;蓝色溶液,说明铜失去电子,转化为铜离子,则操作I中金属废料应该连接电源的正极,2阳极;若另一极采用纯铜,该过程的工业名称为粗铜的精炼。(3)无水是浓盐酸和浓硝酸按照体积比3:1混合而成,所以王水配制的具体操作为取一体积浓硝酸慢慢倒入到三体积浓盐酸中,不断用玻璃棒搅拌。 (4)SO2具有还原性,因此通入SO2的作用是将金从溶液中还原出来;由于在反应中不能还原铂,所以SO2不能通入过量的原因是防止金属铂被还原。(5)阳极泥与王水反应,硝酸被还原为NO,反应的化学方程式为Au+HNO3+4HCl=H[AuCl4]+NO↑+2H2O或3Pt+4HNO3+18HCl=3H2[PtCl6]+4NO↑+8H2O或3Ag+HNO3+3HCl=3AgCl↓+NO↑+2H2O。(6)要制备银-氯化银参比电极,则甲中电极是阳极,银失去电子转化为氯化银,即Ag-e-+Cl-=AgCl。乙池是氢离子放电,0.2g气体是氢气,物质的量是0.1mol,根据电子得失守恒可知消耗氯离子是0.2mol,同时还有0.2mol氢离子从甲池移动到乙池,因此甲池溶液质量变化为减少7.3g。
。(2)电解后产生;蓝色溶液,说明铜失去电子,转化为铜离子,则操作I中金属废料应该连接电源的正极,2阳极;若另一极采用纯铜,该过程的工业名称为粗铜的精炼。(3)无水是浓盐酸和浓硝酸按照体积比3:1混合而成,所以王水配制的具体操作为取一体积浓硝酸慢慢倒入到三体积浓盐酸中,不断用玻璃棒搅拌。 (4)SO2具有还原性,因此通入SO2的作用是将金从溶液中还原出来;由于在反应中不能还原铂,所以SO2不能通入过量的原因是防止金属铂被还原。(5)阳极泥与王水反应,硝酸被还原为NO,反应的化学方程式为Au+HNO3+4HCl=H[AuCl4]+NO↑+2H2O或3Pt+4HNO3+18HCl=3H2[PtCl6]+4NO↑+8H2O或3Ag+HNO3+3HCl=3AgCl↓+NO↑+2H2O。(6)要制备银-氯化银参比电极,则甲中电极是阳极,银失去电子转化为氯化银,即Ag-e-+Cl-=AgCl。乙池是氢离子放电,0.2g气体是氢气,物质的量是0.1mol,根据电子得失守恒可知消耗氯离子是0.2mol,同时还有0.2mol氢离子从甲池移动到乙池,因此甲池溶液质量变化为减少7.3g。

 金钥匙试卷系列答案
金钥匙试卷系列答案