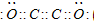题目内容
(10分)现有A、B、C、D、E、F六种物质,已知它们的阳离子有:H+、K+、NH4+、Ca2+、Ba2+、Al3+,阴离子有:OH-、Cl-、ClO-、NO3-、CO32-、SO42-。将上述六种物质溶于水均配成0.1mol/L溶液,进行如下实验。
①仅A、C、D三种溶液显酸性,且酸性强弱顺序为A>D>C。
②D与E反应生成白色沉淀,再加入过量的E沉淀量减少但不消失。
③向F中加入A有无色气体生成。
④B的浓溶液与A的浓溶液混合产生有色且有刺激性气体。
(1)根据以上信息,填写下列溶液中溶质的化学式 C ________ E ________
(2)书写D与过量的E反应的离子方程式。
(3)书写实验④中反应的离子方程式。
(4)向100mLA溶液中慢慢滴加入75mLF溶液和向75mLF溶液中慢慢滴加入100mLA溶液产生的气体体积之比约为____________。
(1) C: NH4NO3 (2分) E: Ba(OH)2 (2分)
(2) 2Al3+ + 3SO42- +8OH- + 3Ba2+ = 2AlO2- + 3BaSO4↓+ 4H2O(2分)
(3) Cl- + ClO- + 2H+ = Cl2↑+ H2O(2分)
(4) 2:1(2分)
【解析】(1)有色气体应该是氯气,所以应该是ClO-氧化Cl-生成氯气。又因为仅A、C、D三种溶液显酸性,且酸性强弱顺序为A>D>C,所以A是氯化氢。由于铝离子的水解程度大于NH4+的水解程度,因此D中含有Al3+,C中含有NH4+。向F中加入A有无色气体生成,所以F是碳酸钾。D与E反应生成白色沉淀,再加入过量的E沉淀量减少但不消失,这说明沉淀应该是氢氧化铝和硫酸钡,则E是氢氧化钡,D是硫酸铝。所以B是次氯酸钙,C是硝酸铵。
(2)D与过量的E反应的离子方程式2Al3+ + 3SO42- +8OH- + 3Ba2+ = 2AlO2- + 3BaSO4↓+ 4H2O。
(3)次氯酸钙具有氧化性,能把氯离子氧化生成氯气,反应的方程式是Cl- + ClO- + 2H+ = Cl2↑+ H2O。
(4)由于碳酸钾和盐酸反应是分步进行的,反应的方程式依次是K2CO3+HCl=KHCO3+KCl、KHCO3+HCl=KCl+H2O+CO2↑。盐酸和碳酸钾的物质的量分别是0.01mol和0.0075mol,则向100mLA溶液中慢慢滴加入75mLF溶液,生成0.005molCO2;向75mLF溶液中慢慢滴加入100mLA溶液产生的气体是0.0025mol,所以二者的体积之比是2︰1。

 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.