题目内容
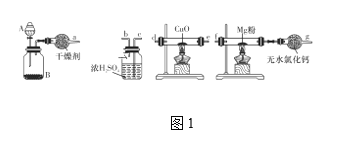
【题目】科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天。如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导正极生成的O2-(O2+4e-=2O2-)。
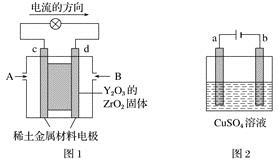
(1)c电极的名称为___,d电极上的电极反应式为___。
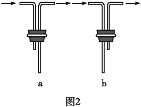
(2)如图2所示用石墨电极电解100mL0.5mol·L-1CuSO4溶液,a电极上的电极反应式为___。
(3)若a电极产生56mL(标准状况)气体,则所得溶液中的c(H+)=___(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入___(填字母)。
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3
【答案】正极 CH4+4O2--8e-=CO2+2H2O 4OH--4e-=2H2O+O2↑(2H2O-4e-= O2↑+4H+) 0.1mol·L-1 ac
【解析】
图1是原电池,依据电流流向是从正极经外电路流向负极可知,c为正极,d为负极;
图2有外接电源,为电解池装置,a与电源正极相连,为阳极,b为阴极,据此分析回答。
(1)由分析可知,图1中c为正极,d为负极,燃料电池中,燃料在负极失电子,被氧化,结合电解质、电荷守恒、原子守恒可得:负极电极反应为:CH4+4O2--8e-=CO2+2H2O,故答案为:正极;CH4+4O2--8e-=CO2+2H2O;![]() 由上面分析可知,图2中:a电极为电解池中的阳极,因为是惰性电极,所以溶液中水电离的氢氧根离子在阳极失电子,被氧化,发生的电极反应为4OH--4e-=2H2O+O2↑(2H2O-4e-= O2↑+4H+),故答案为:4OH--4e-=2H2O+O2↑(2H2O-4e-= O2↑+4H+);
由上面分析可知,图2中:a电极为电解池中的阳极,因为是惰性电极,所以溶液中水电离的氢氧根离子在阳极失电子,被氧化,发生的电极反应为4OH--4e-=2H2O+O2↑(2H2O-4e-= O2↑+4H+),故答案为:4OH--4e-=2H2O+O2↑(2H2O-4e-= O2↑+4H+);
(3) 由4OH--4e-=2H2O+O2↑可知,当产生1mol氧气时,消耗4molOH-,同时产生4molH+,本题中:a电极产生![]() 标准状况
标准状况![]() 氧气,物质的量为
氧气,物质的量为![]() ,消耗氢氧根离子物质的量为0.0025mol×4=0.01mol,故溶液中生成氢离子物质的量为
,消耗氢氧根离子物质的量为0.0025mol×4=0.01mol,故溶液中生成氢离子物质的量为![]() ,则c(H+)
,则c(H+)![]() 0.1mol·L-1。阴极,也就是b极,发生的反应为:Cu2++2e-=Cu,所以电解总反应为:
0.1mol·L-1。阴极,也就是b极,发生的反应为:Cu2++2e-=Cu,所以电解总反应为:![]() ,由总反应可知:电解
,由总反应可知:电解![]() 溶液的过程中,每损失2个Cu原子,就损失2个 O原子,相当于损失一个CuO,为了使
溶液的过程中,每损失2个Cu原子,就损失2个 O原子,相当于损失一个CuO,为了使![]() 溶液,恢复原浓度,应加入:
溶液,恢复原浓度,应加入:
a.损失CuO,加入一定的CuO可以恢复原状,a正确;
b.Cu(OH)2加进去比CuO多了1个H2O,b错误;
c.CuCO3看似多了CO2,但实际上加入后CuCO3和电解产生的硫酸反应生成CO2逸到空气中去了,相当于CuO,c正确;
d.和b同理,多了H2O,d错误;
综上所述:ac正确。
故答案为:1mol·L-1;ac。