题目内容
【题目】铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO。工业上从铝土矿中提取铝可采用如下工艺流程:
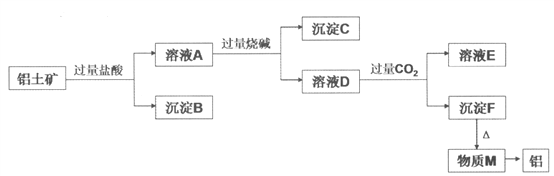
请回答下列问题:
(1)沉淀B的成分是____________(填化学式,下同);
(2)沉淀C的成分是__________;
(3)沉淀F转化为物质M的化学方程式为__________;
(4)由物质M制取铝的化学方程式为____________________;
(5)溶液D中通入过量CO2生成沉淀F的离子方程式为____________________。
【答案】 SiO2 Fe(OH)3、Mg(OH)2 2Al(OH)3![]() Al2O3+3H2O 2Al2O3(熔融)
Al2O3+3H2O 2Al2O3(熔融)![]() 4Al+3O2↑ AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
4Al+3O2↑ AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
【解析】Al2O3、SiO2、Fe2O3、MgO中,Al2O3、SiO2与NaOH溶液反应,MgO、Fe2O3不与NaOH溶液反应;除SiO2不与盐酸反应外,Al2O3、Fe2O3、MgO均与盐酸反应;加入过量盐酸,溶液A为AlCl3、MgCl2、FeCl3,沉淀B为SiO2,加入过量烧碱,沉淀C为Fe(OH)3和Mg(OH)2,溶液D为NaAlO2,通入过量二氧化碳,溶液E为NaHCO3,沉淀F为Al(OH)3,加热分解得到M为Al2O3,经电解可得到Al。
(1)由以上分析可知沉淀B的成分是SiO2,故答案为:SiO2;
(2)沉淀C为Fe(OH)3和Mg(OH)2, 故答案为: Fe(OH)3和Mg(OH)2;
(3)沉淀F为Al(OH)3,加热分解得到M为Al2O3,方程式为2Al(OH)3![]() Al2O3+3H2O,故答案为:2Al(OH)3
Al2O3+3H2O,故答案为:2Al(OH)3![]() Al2O3+3H2O;
Al2O3+3H2O;
(4)Al2O3经电解可得到Al,方程式为2Al2O3(熔融)![]() 4Al+3O2↑,故答案为:2Al2O3(熔融)
4Al+3O2↑,故答案为:2Al2O3(熔融)![]() 4Al+3O2↑;
4Al+3O2↑;
(5)溶液NaAlO2中通入过量CO2生成Al(OH)3沉淀,反应的离子方程式为CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-,故答案为:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】用生石灰(CaO)、纯碱(Na2CO3)和食盐(NaCl)按一定比例混合可制得一种腌制原料,某同学为了探究该原料成份做了以下实验:
该同学取一定量的样品溶于水,主要发生的化学方程式有:____________________________, _____________________________________。
(2)该同学认为(1)过滤后所得的滤液中肯定含有大量的NaOH、NaCl溶质,还可能含有Ca(OH)2或Na2CO3 ,为了探究所得滤液中可能含有的物质是否存在,请你帮他完善实验方案。
实验方案设计如下表所示:
实 验 步 骤 | 实 验 现 象 | 实 验 结 论 | 用离子方程式解释 |
①取少量滤液,滴加适量K2CO3溶液 | 若出现白色沉淀 | 滤液中含Ca(OH)2 | Ⅰ:________________ |
若无白色沉淀 | 滤液中无Ca(OH)2 |
| |
②取少量滤液,______________________________________________ | ⅰ:若出___________ | 滤液中含Na2CO3 | Ⅱ:_______________ |
ⅱ:若无___________ | 滤液中无Na2CO3 |
|