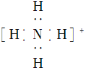题目内容
【题目】H2S是一种大气污染物。干法氧化铁脱硫是目前除去煤气中H2S的常用方法,其原理如图所示。下列说法不正确的是( )
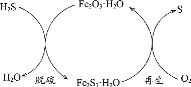
A.单质硫为淡黄色固体
B.脱硫反应为3H2S+Fe2O3·H2O=Fe2S3·H2O+3H2O
C.再生过程中,硫元素被还原
D.脱硫过程中,增大反应物的接触面积可提高脱硫效率
【答案】C
【解析】
A.单质硫为淡黄色的固体,A正确;
B.根据图示脱硫反应时H2S与Fe2O3·H2O生成Fe2S3·H2O和H2O,方程式为:3H2S+Fe2O3·H2O=Fe2S3·H2O+3H2O,B正确;
C.再生过程中Fe2S3·H2O生成S,硫元素化合价升高,被氧化,C错误;
D.脱硫过程中,增大反应物的接触面积能加快反应速率,提高脱硫效率,D正确。
答案选C。

 天天向上一本好卷系列答案
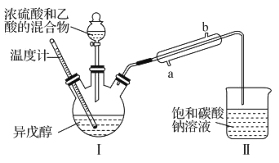
天天向上一本好卷系列答案【题目】乙酸异戊酯是蜜蜂信息素的成分之一,具有香蕉的香味。实验室中可利用乙酸和异戊醇![]() 制备乙酸异戊酯,装置图(夹持装置略)和所用药品有关数据如下。下列说法正确的是( )
制备乙酸异戊酯,装置图(夹持装置略)和所用药品有关数据如下。下列说法正确的是( )
药品 | 密度/( | 沸点/℃ | 水中溶解性 |
异戊醇 | 0.8123 | 131 | 微溶 |
乙酸 | 1.0492 | 118 | 易溶 |
乙酸异戊醇 | 0.8670 | 142 | 难溶 |
A.反应方程式为CH3COOH+![]()
![]()
![]()
B.实验时,冷凝水应从直形冷凝管的b口通入
C.异戊醇的同分异构体中属于醇类的有7种
D.反应后,取Ⅱ中物质经水洗、碱洗和蒸馏可提纯乙酸异戊酯
【题目】某小组探究![]() 溶液和
溶液和![]() 溶液的反应原理。
溶液的反应原理。
(实验一)将含淀粉的![]() 溶液加入
溶液加入![]() 酸性溶液(过量)中,混合后约5秒内无明显变化,随后有少量蓝色出现并迅速变蓝。
酸性溶液(过量)中,混合后约5秒内无明显变化,随后有少量蓝色出现并迅速变蓝。
(1)溶液变蓝,说明![]() 具有__________性。
具有__________性。
(2)查阅文献:
反应Ⅰ:![]() 慢
慢
反应Ⅱ:![]() _____=_____+_____ 较快
_____=_____+_____ 较快
反应Ⅲ:![]() 快
快
写出酸性条件下,反应Ⅱ的离子方程式__________。
(3)向实验一所得蓝色溶液中加入少量![]() 溶液,蓝色迅速褪去,后又变蓝色。据此得出
溶液,蓝色迅速褪去,后又变蓝色。据此得出![]() 氧化性比
氧化性比![]() 强,该结论______(填“合理”或“不合理”),理由是_________。
强,该结论______(填“合理”或“不合理”),理由是_________。
(4)为了进一步研究![]() 溶液和
溶液和![]() 溶液的反应原理,设计如下实验。
溶液的反应原理,设计如下实验。
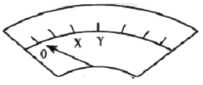
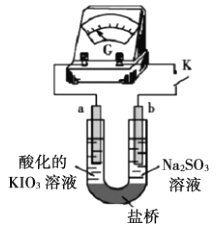
(实验二)装置如图所示,![]() 闭合后,电流表的指针偏转情况记录如表:
闭合后,电流表的指针偏转情况记录如表:
表盘 |
|
| ||
时间/min |
|
|
| |
偏转位置 | 右偏至“Y”处 | 指针回到“0”处,又返至“X”处;如此周期性往复多次…… | 指针归零 | |
①![]() 闭合后,检验b极附近溶液存在放电产物
闭合后,检验b极附近溶液存在放电产物![]() 的实验操作是__________。
的实验操作是__________。
②![]() 时,直接向a极区滴加淀粉溶液,溶液未变蓝。取a极附近溶液于试管中,滴加淀粉溶液,溶液变蓝。判断
时,直接向a极区滴加淀粉溶液,溶液未变蓝。取a极附近溶液于试管中,滴加淀粉溶液,溶液变蓝。判断![]() 在a极放电的产物是__________。
在a极放电的产物是__________。
(5)下列关于上述实验解释合理的是__________(填字母序号)。
A.实验一中:5秒内无明显变化,可能是因为反应Ⅰ的活化能太小,反应速率太慢
B.实验二中:指针回到“0”处,可能是因为反应Ⅱ比反应Ⅰ快,导致![]() 难与
难与![]() 发生反应
发生反应
C.实验二中:又返至“X”处,可能是因为发生了反应Ⅲ,重新形成了原电池
【题目】某小组同学设计实验,探究中和反应的发生。
(实验过程)
编号 | 实验操作 |
实验I | 向滴有酚酞的氢氧化钠溶液中滴加稀盐酸,观察现象
|
实验II | 按如图进行实验,对比①、②中的实验现象
|
(分析与解释)
(1)中和反应的实质是______(用离子方程式表示)。
(2)实验I中,中和反应发生的现象是______。
(3)实验II中,能判断中和反应发生的依据是______。
a.反应结束消耗镁条的量②>①
b.镁条表面产生气泡的速率①>②
(4)实验II中,如果提供温度计、气球(收集气体)等辅助仪器,还能获取证明中和反应发生的实验证据是______。