题目内容
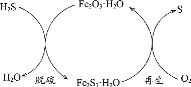
【题目】化学工程师为了变废为宝,从某工业废液(含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费)中回收铜,并将铁的化合物全部转化为化工原料FeCl3晶体,主要流程如下:
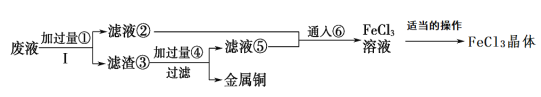
(1)步骤Ⅰ的操作名称:__________;
(2)检验滤液中②是否含有Fe3+所需试剂化学式:_____________,
(3)向②中加入NaOH溶液并长时间暴露在空气中,此过程的现象:________。
(4)滤渣③加入过量的④发生的离子方程式____________,
(5)通入⑥的目的:_______________。
【答案】过滤 KSCN溶液或硫氰化钾溶液 溶液从白色沉淀很快成灰绿色,最终变成红褐色 Fe+2H+=Fe2+ +H2↑ 将溶液中的Fe2+完全转化成Fe3+
【解析】
从废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用,则废液中加过量③(Fe粉),滤液为FeCl2,滤渣为Fe和Cu,滤渣中加过量④(盐酸),因Cu与盐酸不反应,则滤液⑤为FeCl2,将滤液②和⑤中通入⑥(氯气),可反应得到FeCl3溶液。
(1)步骤Ⅰ为分离氯化亚铁溶液和固体铁、铜,操作名称为过滤,本题答案为:过滤;
(2)检验滤液中②是否含有Fe3+所需试剂为硫氰化钾,硫氰化钾遇Fe3+变红,化学式为KSCN,本题答案为:KSCN溶液或硫氰化钾溶液;
(3)②为氯化亚铁溶液,加入NaOH溶液会生成白色絮状沉淀,白色沉淀迅速转化为灰绿色,最终变为红褐色,故答案为:溶液从白色沉淀很快成灰绿色,最终变成红褐色;
(4)滤渣③含有铁和铜,加入过量的盐酸,铜与盐酸不反应,只有铁与硫酸反应,生成硫酸亚铁和氢气,离子方程式为Fe+2H+=Fe2+ +H2↑,本题答案为Fe+2H+=Fe2+ +H2↑;
(5)滤液②和⑤中的溶质为氯化亚铁,通入氯气,可将氯化亚铁氧化成FeCl3溶液,本答案为:将溶液中的Fe2+完全转化成Fe3+。

 阅读快车系列答案
阅读快车系列答案