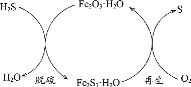
题目内容
【题目】某小组同学设计实验,探究中和反应的发生。
(实验过程)
编号 | 实验操作 |
实验I | 向滴有酚酞的氢氧化钠溶液中滴加稀盐酸,观察现象
|
实验II | 按如图进行实验,对比①、②中的实验现象
|
(分析与解释)
(1)中和反应的实质是______(用离子方程式表示)。
(2)实验I中,中和反应发生的现象是______。
(3)实验II中,能判断中和反应发生的依据是______。
a.反应结束消耗镁条的量②>①
b.镁条表面产生气泡的速率①>②
(4)实验II中,如果提供温度计、气球(收集气体)等辅助仪器,还能获取证明中和反应发生的实验证据是______。
【答案】H++OH-=H2O 溶液由红色逐渐变为无色 b 相同温度和压强下,用气球收集①、②中完全反应时产生的气体,①中收集气体的气球比②中收集气体的气球体积大。
【解析】
实验I:由于酚酞遇碱变红,向氢氧化钠溶液中滴加酚酞,溶液变红,再向溶液中滴加盐酸,发生酸碱中和反应,溶液中氢氧根离子被消耗,随着盐酸的滴加,氢氧根离子逐渐减少至完全被消耗,溶液由红色逐渐变为无色;
实验II:操作①、②中盐酸的物质的量相同,直接与打磨过的相同质量的镁条反应,发生的离子反应都为:Mg+2H+= Mg2++H2↑,完全反应后,①、②中消耗镁条的质量相同;若操作①先加水稀释,氢离子的总的物质的量不变,操作②先加氢氧化钠溶液发生反应生成水,氢离子的总的物质的量减小,①、②中都进行操作i后,溶液体积都为6mL,则①中的氢离子浓度大于②中氢离子的浓度,都与打磨过的相同质量的镁条反应,完全反应后,①中消耗的镁条的质量比②中消耗的镁条质量更多,①中的氢离子浓度大,与镁条反应时的速率①>②,综上分析②中加入氢氧化钠后氢离子被消耗,证明加入氢氧化钠后与盐酸发生了中和反应,据此分析解答。
(1)中和反应的实质是H++OH-=H2O;
(2)实验I中,中和反应发生的现象是溶液由红色逐渐变为无色;
(3)根据分析,实验II中,反应结束消耗镁条的量①>②,镁条表面产生气泡的速率①>②,则能判断中和反应发生的依据是b;
(4)实验II中,由于氢离子的物质的量①>②,镁条完全反应时,相同条件下,产生氢气的体积①>②,如果提供温度计、气球(收集气体)等辅助仪器,还能获取证明中和反应发生的实验证据是相同温度和压强下,用气球收集①、②中完全反应时产生的气体,①中收集气体的气球比②中收集气体的气球体积大。