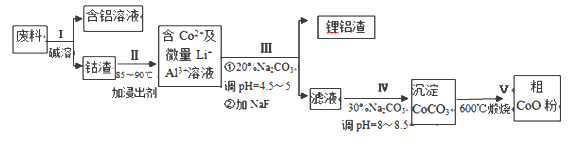
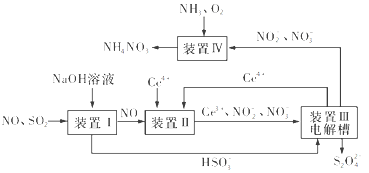
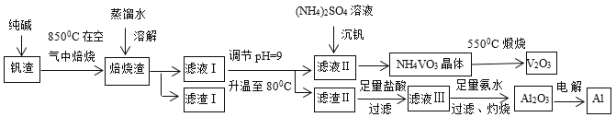
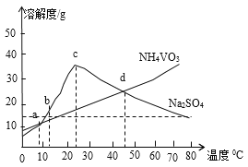
题目内容
【题目】I.在450℃并有催化剂存在下,在容积恒定的密闭容器内进行下列反应:2SO2 (g)+O2(g)![]() 2SO3(g) △H=-190kJmol-1
2SO3(g) △H=-190kJmol-1
(1)该反应500℃时的平衡常数____450℃时的平衡常数(填“>”、“<”或“=”)。
(2)450℃时,在2L密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是____。

(3)据上图判断,反应进行至20min时,曲线发生变化的原因是___(用文字表达),10min到15min的曲线变化的原因可能是___(填字母)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3物质的量
(4)欲提高SO2的转化率,下列措施可行的是___。(填字母)
a.向装置中充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
II.已知HCl+O2![]() Cl2+H2O(未配平)中2mol HCl被氧化,放出57.8kJ的热量,且部分化学键断裂示意图如下:
Cl2+H2O(未配平)中2mol HCl被氧化,放出57.8kJ的热量,且部分化学键断裂示意图如下:

①写出该反应的热化学方程式是_____。
②断开1 mol H—O键与断开 1 mol H—Cl键所需能量相差约为___kJ,H2O中H—O键比HCl中H—Cl键_____(填“强”或“弱”)。
【答案】< 15~20min、25~30min 增大O2的浓度 ab b 4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) △H=-115.6kJ·mol-1 31.9 强
2Cl2(g)+2H2O(g) △H=-115.6kJ·mol-1 31.9 强
【解析】
I.(1)考查化学平衡常数,该反应为放热反应,升高温度,化学平衡常数减小,即500℃时的平衡常数<450℃时的平衡常数;
(2)达到平衡,组分的物质的量保持不变,因此处于平衡状态的时间是15~20min、25~30min;
(3)根据图像,20min时O2的物质的量突增,SO2物质的量减少,SO3物质的量增多,说明20min时增大O2的浓度;由图可以知道,反应向正反应进行,10min到15min反应混合物单位时间内的变化量增大,即化学反应速率增大,10min改变瞬间,各物质的物质的量不变,a、使用催化剂,增大反应速率,故a符合题意;
b、缩小容器的体积,增大压强,增大反应速率,故b符合题意;
c、降低温度,反应速率降低,故c不符合题意;
d、10min改变瞬间,各物质的物质的量不变,不是增加SO3的物质的量,故d不符合题意;
(4)提高SO2的转化率,化学平衡向正反应方向移动,a、恒温恒容状态,充入N2,N2不参与反应,组分的浓度保持不变,平衡不移动,SO2转化率不变,故a不符合题意;
b、向装置再充入O2,平衡向正反应方向移动,SO2的转化率增大,故b符合题意;
c、催化剂只影响化学反应速率,对化学平衡不移动,SO2的转化率不变,故c不符合题意;
d、该反应为放热反应,升高温度,平衡向逆反应方向进行,SO2的转化率降低,故d不符合题意;
II.①配平后的反应方程式为4HCl+O2![]() 2Cl2+2H2O,因此4molHCl被氧化,放出的热量为4mol×57.8 kJ/2mol=115.6kJ,因此热化学反应方程式为4HCl(g)+O2(g)
2Cl2+2H2O,因此4molHCl被氧化,放出的热量为4mol×57.8 kJ/2mol=115.6kJ,因此热化学反应方程式为4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) △H=-115.6kJ·mol-1;
2Cl2(g)+2H2O(g) △H=-115.6kJ·mol-1;
②令H-O的键能为x,H-Cl的键能为y,利用△H=反应物的键能总和-生成物的键能总和=(4ykJ·mol-1+498kJ·mol-1-2×243kJ·mol-1-2×2×xkJ·mol-1)=-115.6kJ·mol-1,解得y-x=-31.9;H2O中H-O键比HCl中H-Cl键强。

 阅读快车系列答案
阅读快车系列答案