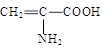题目内容
已知某无色溶液中可能含有Na+、Ba2+、Fe3+、MnO4—、SO32—、Cl—、HCO3— 中的几种,依次进行以下实验,观察到的现象如下:①用PH试纸检验,溶液的PH>7;
②向溶液中滴加氯水,没有气体产生,得到无色溶液;
③向②的溶液中滴加硝酸酸化硝酸银溶液,产生白色沉淀;
④向②的溶液中滴加BaCl2溶液,产生不溶于盐酸的白色沉淀。
则(1)原溶液中一定含有的阴离子是 ;肯定没有的阳离子是 。
(2)步骤②的离子反应方程式为 。
(3)能否确定含有阳离子 ,(若有,写出离子符号,没有则写没有),其理由是 。
②向溶液中滴加氯水,没有气体产生,得到无色溶液;
③向②的溶液中滴加硝酸酸化硝酸银溶液,产生白色沉淀;
④向②的溶液中滴加BaCl2溶液,产生不溶于盐酸的白色沉淀。
则(1)原溶液中一定含有的阴离子是 ;肯定没有的阳离子是 。
(2)步骤②的离子反应方程式为 。
(3)能否确定含有阳离子 ,(若有,写出离子符号,没有则写没有),其理由是 。
(10分)(1)SO32— ;Ba2+、Fe3+ (2)Cl2 + SO32— + H2O=2H+ + 2Cl— + SO42—
(3)Na+;溶液不显电性,所以有阴离子,必然有阳离子,而无色溶液排除了Fe3+,含有SO32— 而排除了Ba2+,阳离子只剩下Na+,所以一定有Na+。
(3)Na+;溶液不显电性,所以有阴离子,必然有阳离子,而无色溶液排除了Fe3+,含有SO32— 而排除了Ba2+,阳离子只剩下Na+,所以一定有Na+。
试题分析:溶液是无色的,则溶液中一定没有Fe3+、MnO4—;①用pH试纸检验,溶液的pH>7,即溶液显碱性,所以一定没有HCO3—;氯离子不能水解,所以一定含有SO32—,SO32—水解溶液显碱性;有SO32—,则就一定没有Ba2+;溶液不可能没有阳离子,所以溶液中一定含有钠离子;向②的溶液中滴加硝酸酸化硝酸银溶液,产生白色沉淀;②向溶液中滴加氯水,没有气体产生,得到无色溶液,进一步说明含有SO32—,因为SO32—具有还原性,被氯水氧化生成SO42—;③向②的溶液中滴加硝酸酸化硝酸银溶液,产生白色沉淀,由于②中加入了氯水,不能确定是否含有氯离子。④向②的溶液中滴加BaCl2溶液,产生不溶于盐酸的白色沉淀,该白色沉淀是硫酸钡。
(1)原溶液中一定含有的阴离子是SO32— ;肯定没有的阳离子是Ba2+、Fe3+。
(2)步骤②的离子反应方程式为Cl2 + SO32— + H2O=2H+ + 2Cl— + SO42—。
(3)由于溶液不显电性,所以有阴离子,必然有阳离子,而无色溶液排除了Fe3+,含有SO32— 而排除了Ba2+,阳离子只剩下Na+,所以一定有Na+。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,对学生的思维能力要求高,有利于培养学生的逻辑推理能力和逆向思维能力,有助于提升学生的学科素养,提高学生的应试能力和答题技巧。答题时注意从物质的性质以及反应现象推断,注意找准突破点。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目