题目内容
下列实验事实所得出的结论中,错误的是
| A.向A gCl沉淀中滴入稀KI溶液白色沉淀变黄,说明AgI比AgCl更难溶 |
| B.加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中一定有CO32- |
| C.先加入盐酸无 沉淀,再加入Ba Cl2溶液产生白色沉淀,则试样中一定有SO42- |
| D.盐溶液中加入NaOH微热,产生使湿润的红色石蕊试纸变蓝的气体,则一定是铵盐 |
B
试题分析:向A gCl沉淀中滴入稀KI溶液白色沉淀变黄,说明AgI比AgCl更难溶,故A正确;加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中可能有CO32-,也有可能含有HCO3-,所以B错误,为本题的答案;C正确,先加入盐酸无 沉淀,再加入Ba Cl2溶液产生白色沉淀,则试样中一定有SO42-;D正确,盐溶液中加入NaOH微热,产生使湿润的红色石蕊试纸变蓝的气体,该气体为氨气,则一定是铵盐。
点评:本题考查了常见物质的检验,属于对基础知识的考查,本题考查的都是学生熟悉的知识点,该题难度不大。

练习册系列答案
相关题目
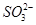 之间发生怎样的反应,请你一起参与并协助他们完成实验。(1)提出猜想:
之间发生怎样的反应,请你一起参与并协助他们完成实验。(1)提出猜想: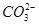 小外,还有_ _______。
小外,还有_ _______。