题目内容
向含有下列微粒的溶液中分别加入少量NaOH固体、少量浓盐酸或少量酸性高锰酸钾溶液,都能使该微粒浓度下降的是
| A.Fe3+ | B.HS— | C.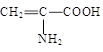 | D.C6H5O— |
BC
试题分析:A、氢氧化钠和铁离子反应生成氢氧化铁红褐色沉淀,铁离子浓度降低;少量浓盐酸或少量酸性高锰酸钾溶液抑制铁离子水解,铁离子浓度升高,A不正确;B、氢氧化钠和HS-反应生成S2-,浓度降低;盐酸和HS-反应放出H2S气体,浓度降低。高锰酸钾氧化HS-,浓度降低,B正确;C、羧基消耗能和氢氧化钠溶液反应,浓度降低。氨基能和盐酸反应,浓度降低。酸性高锰酸钾溶液能氧化碳碳双键,浓度降低,C正确;D、氢氧化钠抑制C6H5O—,浓度升高。盐酸和C6H5O—反应生成苯酚,浓度降低。酸性高锰酸钾溶液氧化C6H5O—,浓度降低,D不正确,答案选BC。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 ,H2SO3,NH
,H2SO3,NH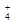 )分别进行如下实验:
)分别进行如下实验: 、
、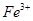 、
、 、
、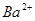 、
、 等阳离子。某同学进行如下实验:
等阳离子。某同学进行如下实验: 溶液至溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。
溶液至溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。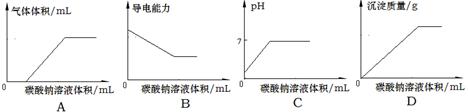
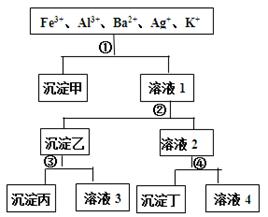
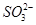 之间发生怎样的反应,请你一起参与并协助他们完成实验。(1)提出猜想:
之间发生怎样的反应,请你一起参与并协助他们完成实验。(1)提出猜想: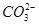 小外,还有_ _______。
小外,还有_ _______。