题目内容
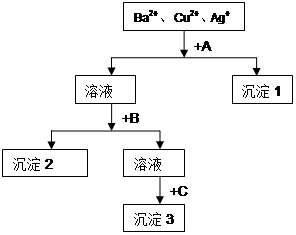
现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图,请计算出FeCl3、AlCl3的物质的量浓度各为多少?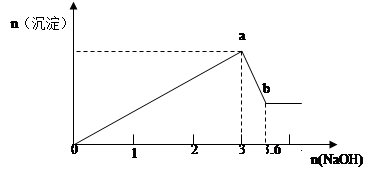

FeCl3、AlCl3的物质的量浓度各为4mol/L、6mol/L(要写出规范的计算过程)
试题分析:由Fe3+ + 3OH- = Fe(OH)3↓ Al3+ + 3OH- =Al(OH)3↓得当所有Fe3+和 Al3+都沉淀完全时,,达到最大沉淀量a,消耗OH-3mol,即FeCl3、AlCl3共1mol
继续加NaOH,Al(OH)3逐渐溶解,Al(OH)3 + OH- =AlO2- +H2O
消耗OH-共0.6mol。所以可以由原子守恒得出AlCl3的物质的量为0.6mol,所以FeCl3物质的量为0.4mol。
c(FeCl3)=n/V=0.4mol/0.1L=4mol/L,c(AlCl3)=n/V=0.6mol/0.1L=6mol/L。
点评:在此总结一下对于图象问题的分析方法:(1)认清坐标系,搞清纵、横坐标所代表的意义。(2)看清起点、拐点、终点,看清曲线的变化趋势,并弄清楚各点的物理意义。

练习册系列答案
相关题目
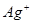 、
、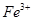 、
、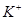 、
、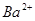 、
、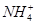 等阳离子。某同学进行如下实验:
等阳离子。某同学进行如下实验: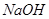 溶液至溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。
溶液至溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。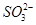 之间发生怎样的反应,请你一起参与并协助他们完成实验。(1)提出猜想:
之间发生怎样的反应,请你一起参与并协助他们完成实验。(1)提出猜想: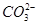 小外,还有_ _______。
小外,还有_ _______。