题目内容
【题目】学习选修5的学生必做题
(1)由两种烃组成的混合气体2L与足量的氧气充分反应后生成CO2 5L、H2O 7L(所有体积都在120℃测定),则这两种混合气体的可能组成是( )
A.C2H4、C3H8 B.CH4、C5H8 C.CH4、C4H8 D.C2H6、C3H8
(2)下列变化中,由加成反应引起的是( )
A.乙烯通入酸性高锰酸钾溶液中,高锰酸钾溶液褪色
B.苯在一定温度、压强和催化剂的作用下和氢气反应,生成环己烷
C.一定条件下,苯滴入浓硝酸和浓硫酸的混合液中,有油状物生成
D.由电石制乙炔
(3)下列说法正确的是( )
- 甲苯的一氯代物有4种,将甲苯加氢饱和后的产物的一氯代物也有4种
B.所有汽油都可以用于萃取溴水中的溴
C.通过核磁共振氢谱图可以知道有机物的空间等效氢原子种类和数目
D.分子式为C6H12的烯烃,主链上有四个碳原子的同分异构体只有4种
(4)以煤为原料制备一些化工产品的前景被看好。下图是以煤为原料生产聚氯乙烯(PVC)和人造羊毛的合成路线。
![]()
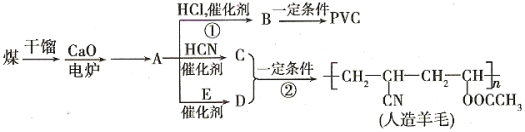
请回答下列问题:
①反应①反应类型________________E中官能团名称__________。
②写出结构简式:PVC_________________C_____________________。
③写出反应③的化学方程式:_____________________________________________。
④写出A![]() D的化学反应方程式___________________________________________。
D的化学反应方程式___________________________________________。
【答案】(1)D(2)B(3)CD(4)①加成反应,羧基;
②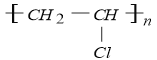 CH2=CHCN
CH2=CHCN
③![]() ④CH≡CH+CH3COOH→CH2=CHOOCCH3
④CH≡CH+CH3COOH→CH2=CHOOCCH3
【解析】
试题分析:(1)同温同压下,气体的体积之比等于物质的量之比,由混合气体2L与足量的氧气充分反应后生成CO2 5L、H2O 7L(所有体积都在120℃测定)可知,混合气体的最简式为C2.5H7。
A.当C=2.5时,两种烃的物质的量之比为1:1,此时H=6,不符合题意,A错误;
B.当C=2.5时,两种烃的物质的量之比为5:3,此时H=5.5,不符合题意,B错误;
C.当C=2.5时,两种烃的物质的量之比为1:1,此时H=6,不符合题意,C错误;
D.当C=2.5时,两种烃的物质的量之比为1:1,此时H=7,符合题意,D正确;
故答案D。
(2)A.乙烯通入酸性高锰酸钾溶液中,高锰酸钾溶液褪色,是由氧化反应引起的,A错误;B.苯在一定温度、压强和催化剂的作用下和氢气反应,生成环己烷,加成反应,B正确;C.一定条件下,苯滴入浓硝酸和浓硫酸的混合液中,有油状物生成,取代反应,C错误;D.电石为碳化钙,由碳化钙与水反应制取乙炔,不是取代反应,D错误。故答案B。
(3)A.甲苯的一氯代物可以取代苯环上的氢,也可以取代甲基上的氢,将甲苯加氢饱和后的产物是甲基环己烷,分子中有5种不同环境的氢,其一氯代物有5种,A错误;B.不是所有汽油都可以用于萃取溴水中的溴,比如裂化汽油中含有不饱和烃,能够与溴发生加成反应,因此不能用来萃取溴水中的溴,B错误;C.通过核磁共振氢谱图可以知道有机物的空间等效氢原子种类和数目,C正确;D.分子式为C6H12的烯烃,主链上有四个碳原子,若只有一个支链,则另外两个碳形成乙基,只有1种;若有2个支链,则有2个甲基,共有3种,故其同分异构体只有4种,D正确。故答案CD。
(4)由转化关系可知,A为乙炔CH≡CH,CH≡CH与HCl在催化剂作用下发生加成反应生成B,则B为CH2=CHCl,CH2=CHCl在一定条件下发生加聚反应,生成PVC,则PVC为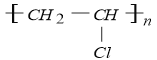 ;CH≡CH与HCN在催化剂作用下发生加成反应生成C,则C为CH2=CHCN,CH2=CHCN与D发生加聚反应合成人造羊毛,则D为CH2=CHOOCCH3,乙炔与E反应生成CH2=CHOOCCH3,则E为CH3COOH,据此回答问题。
;CH≡CH与HCN在催化剂作用下发生加成反应生成C,则C为CH2=CHCN,CH2=CHCN与D发生加聚反应合成人造羊毛,则D为CH2=CHOOCCH3,乙炔与E反应生成CH2=CHOOCCH3,则E为CH3COOH,据此回答问题。
①反应①为乙炔与HCl的反应,属于加成反应,E为CH3COOH,含有的官能团为羧基;
②PVC为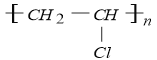 ,C为乙炔与HCN的加成产物CH2=CHCN;
,C为乙炔与HCN的加成产物CH2=CHCN;
- ③反应③是碳化钙与水反应制取乙炔,方程式为CaC2+2H2O→CH≡CH↑+Ca(OH)2;
- A
 D的化学反应方程式为CH≡CH+CH3COOH→CH2=CHOOCCH3。
D的化学反应方程式为CH≡CH+CH3COOH→CH2=CHOOCCH3。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案【题目】以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命。
(1)以甲醇为原料制取高纯H2是重要研究方向。甲醇水蒸气重整制氢主要发生以下两个反应:
主反应:CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) △H=+49 kJmol-1
CO2(g)+3H2(g) △H=+49 kJmol-1
副反应:H2(g)+CO2(g)![]() CO(g)+H2O(g) △H=+41 kJmol-1
CO(g)+H2O(g) △H=+41 kJmol-1
①甲醇在催化剂作用下裂解可得到H2和CO,则该反应的化学方程式为_________________________,既能加快反应速率又能提高CH3OH平衡转化率的一种措施是_________________________。
②分析适当增大水醇比(nH2O∶nCH3OH)对甲醇水蒸气重整制氢的好处_________________________。
③某温度下,将nH2O∶nCH3OH =1∶1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为_________________________。(忽略副反应)
(2)工业常用CH4 与水蒸气在一定条件下来制取H2,其原理为:
CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+203kJ·mol-1
①该反应的逆反应速率表达式为; V逆=k·c(CO)·c3(H2),k为速率常数,在某温度下,测得实验数据如表:
CO浓度(mol·L-1) | H2浓度(mol·L-1) | 逆反应速率(mol·L-1·min-1) |
0.05 | C1 | 4.8 |
c2 | C1 | 19.2 |
c2 | 0.15 | 8.1 |
由上述数据可得该温度下,上述反应的逆反应速率常数k 为__________L3·mol-3·min-1。
②在体积为3L的密闭容器中通入物质的量均为3mol 的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图所示,则压强Pl_____P2(填“大于”或“小于”)温度T3_______T4(填“大于”或“小于”);压强为P1时,在N点; v正_______v逆(填“大于”或“小于”或“等于”)。求N点对应温度下该反应的平衡常数 K=_____________________。

【题目】三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料生产NiCl2,继而生产Ni2O3的工艺流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
开始沉淀的pH | 1.8 | 5.8 | 3.0 | 7.1 |
沉淀完全的pH | 3.2 | 8.8 | 5.0 | 9.2 |
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有①适当升高温度;②搅拌;③________等。
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等。沉镍前需加Na2CO3控制溶液pH范围为____________________。
(3)从滤液A中可回收利用的主要物质是Na2CO3和________。
(4)“氧化”生成Ni2O3的离子方程式为__________________________________。
(5)工业上用镍为阳极,电解0.05~0.1 mol·L-1 NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示,则①NH4Cl的浓度最好控制为__________________________。
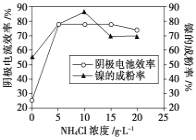
②当NH4Cl的浓度大于15g·L-1时,阴极有气体生成,导致阴极电流效率降低,写出相应的电极反应式:________________________。
(6)如果在“沉镍”步骤把Na2CO3改为加草酸,则可以制得草酸镍晶体(NiC2O4·2H2O)。草酸镍晶体在热空气中干燥脱水后在高温下煅烧三小时,可以制得Ni2O3,同时获得混合气体。草酸镍晶体受热分解的化学方程式为___________________________________。