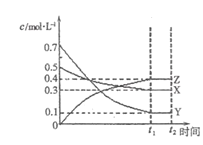
题目内容
【题目】氢溴酸常用于合成镇静剂和麻醉剂等医药用品。已知: 液溴是易挥发的深红棕色液体,沸点为58.78℃。质量分数为47%的氢溴酸是易挥发的无色液体,沸点 为 126℃. 实验室制备质量分数为47%的氢溴酸的一种方法如下。回答下列问题:
实验橾作 | 现象 |
I .向锥形瓶中依次加入适量冰水、m1g 液溴,再通入SO2充分反应 | 得到淡黄色溶液 |
II. 将操作 I 所得溶液转移至蒸馏烧瓶,蒸馏 | 锥形瓶中得橙黄色粗产品 |
III.在不断搅拌下,向锥形瓶中加入适量Na2SO3溶液 | (1)①_____ |
IV.继续加入适量 Ba(OH)2 溶液 | ②______ |
V.过滤,滤液经蒸馏后得质量分数为47%的氢溴酸m2g |
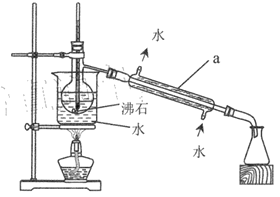
(2)操作 II的蒸馏装置如图所示(部分夹持装置省略),仪器a的名称是_________ ,装置中除缺石棉网外还有两处明显错误,分别是_________、 _______________。
(3)操作III加入适量Na2SO3 发生反应的离子方程式为 __________。
(4)工业生产制得的氢溴酸常常有淡淡的黄色, 有同学推测是因为含Fe3+,可用试剂 __________检验。若观察到的现象为________,则推测正确。
(5)质量分数为 47%的氢溴酸的产率为__________。
【答案】溶液变成无色 有白色沉淀生成 直形冷凝管 温度计感应泡应与蒸馏烧瓶支管口相平 不能用水裕加热 SO32-+Br2 +H2O=2Br-+ SO42+2H+ KSCN溶液 溶液变为红色 ![]()
【解析】
液溴与二氧化硫在锥形瓶中发生反应:Br2+SO2+2H2O=H2SO4+2HBr,为防止溴的挥发加入适量冰水,反应后的溶液进行蒸馏后得到氢溴酸粗产品,由于溴的挥发,得到的产品有少量液溴,加入具有还原性的Na2SO3溶液除去产品中残留的少量溴,亚硫酸根被氧化为硫酸根,再加入适量 Ba(OH)2 溶液除去溶液中的硫酸根离子,最后经过滤、蒸馏得到47%的氢溴酸,以此分析解答此题。
(1)①由分析可知,由于溴易挥发,得到的粗产品中有少量的溴,加入还原性的Na2SO3溶液除去产品中残留的少量溴,反应后溶液由橙黄色变为无色,答案为:溶液变成无色;
②Na2SO3溶液与溴反应后被氧化为Na2SO4,加入适量 Ba(OH)2 溶液后发生反应:Ba2++SO42-=BaSO4↓,生成白色的BaSO4沉淀,答案为:有白色沉淀生成;
(2) 仪器a为直形冷凝管,蒸馏实验中温度计测量的是蒸气的温度,温度计感应泡应与蒸馏烧瓶支管口相平,而不应该伸到液体里面,由信息可知氢溴酸沸点为126℃,故不能用水浴加热,答案为:直形冷凝管;温度计感应泡应与蒸馏烧瓶支管口相平;不能用水裕加热;
(3) 由分析可知,操作III加入适量Na2SO3 目的是除去产品中残留的少量溴,溴被亚硫酸根还原,亚硫酸根被氧化为硫酸根,根据得失电子守恒、电荷守恒,发生反应的离子方程式为:SO32-+Br2 +H2O=2Br-+ SO42+2H+
(4) Fe3+离子的检验可向溶液中滴入几滴KSCN溶液,如果观察到溶液变为红色,证明原溶液中有Fe3+离子,答案为:KSCN溶液;溶液变为红色;
(5)根据溴守恒有关系式;Br2~2HBr,设HBr的理论产量为x
 解得x=
解得x=![]() ,所以质量分数为 47%的氢溴酸的产率=
,所以质量分数为 47%的氢溴酸的产率=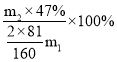 =
=![]() 。
。

【题目】钴元素由于其良好的物理化学性质,被广泛应用于生产生活中。从含钴废料(含CoO、Co2O3、单质Al、Li等)中制取粗CoCl2·6H2O的流程如下所示。
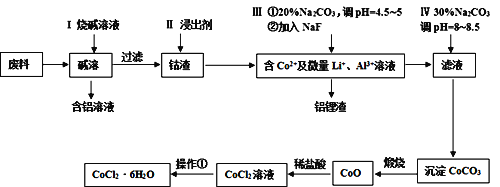
请回答下列问题:
(1)步骤I中主要发生的化学反应方程式为______。
(2)已知Co2O3具有强氧化性,若步骤II中浸出剂为盐酸,造成的后果是_______。
(3)步骤Ⅲ中①的目的是除去Al3+,写出该步反应的离子方程式______。
(4)若在实验室煅烧CoCO3,所需的硅酸盐质仪器除酒精灯和玻璃棒外,还有______、______(填仪器名称)。
(5)操作①是在HCl氛围中进行的,其步骤是______、_____、过滤、洗涤、干燥。洗涤过程中可以用工业酒精代替水,其优点是_____。
(6)某同学用标准硝酸银溶液滴定未知浓度的CoCl2溶液,下列可作为指示剂的是____(填选项,忽略亚钴离子的颜色干扰)
A.KCl B.KSCN C.K2CrO4 D.K2S
已知几种物质在20℃时的颜色及Ksp值如下表
化学式 | AgCl | AgSCN | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黑色 | 红色 |
Ksp | 2.0×10-10 | 1.0×10-12 | 2.0×10-48 | 2.0×10-12 |