��Ŀ����
����Ŀ������ͼ��ʾ��һ�ܱ���������Ħ�����ɻ�����������a��b�ֳɼס������ң���״���£��������г���NH30.4mol�������г���HCl��N2�Ļ�����壬��ֹʱ����λ����ͼ��ʾ����֪�ס������������������֮��Ϊ17.3g��
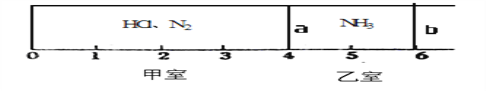
��1��������HCl��N2������֮��Ϊ__________________��
��2��������aȥ����һ��ʱ�����b���ȶ�λ�ڿ̶ȡ�________�����������֣������ǹ������ʲ�����ѹǿ������ʱ��ϵ��ƽ����Է�������Ϊ________��
����֪���ᡢ��ˮ���ܶ�������ˮ�����Ĺ�ϵ��ͼ��ʾ�����������백ˮ��һ�ݣ�����ݱ�����Ϣ���ش��������⣺
���ʵ����ʵ���Ũ��/molL-1 | ��Һ���ܶ�/gcm-3 | |
���� | c1 | ��1 |
��ˮ | c2 | ��2 |
��1�������������������Ϊ________����д��λ���ú�c1����1�Ĵ���ʽ��ʾ����
��2�����ʵ���Ũ��Ϊc1molL-1��������ˮ�������ϣ���Ϻ���Һ������仯���Բ��ƣ���������Һ�����ʵ���Ũ��Ϊ________molL-1��
��3�������ʵ���Ũ�ȷֱ�Ϊc2molL-1��0.2c2molL-1�İ�ˮ��������ϣ�������Һ�����ʵ���Ũ��__________0.6c2molL-1������ڡ�����С�ڡ����ڡ��������Ϻ���Һ������仯���Բ��ƣ���
���𰸡� 73��168 4 25.25 ![]() C1/2 ����
C1/2 ����
��������������Ҫ�����й����ʵ����ļ��㡣
��1��������0.4molNH3������Ϊ6.8g��������HCl��N2�����������ʵ����ǰ�������Ϊ0.8mol������Ϊ(6.8+17.3)g=24.1g��n(HCl)+n(N2)=0.8mol��36.5g/mol��n(HCl)+28g/mol��n(N2)=24.1g�����n(HCl)=0.2mol��n(N2)=0.6mol��������HCl��N2������֮��Ϊ(36.5��0.2):(28��0.6)=73:168��
��2��������aȥ����һ��ʱ���NH3+HCl![]() NH4Cl���÷�Ӧʣ��0.2mol��������b���ȶ�λ�ڿ̶ȡ�4��������ʱ��ϵ��ƽ����Է�������Ϊ(0.2��17+0.6��28)/(0.2+0.6)=25.25��
NH4Cl���÷�Ӧʣ��0.2mol��������b���ȶ�λ�ڿ̶ȡ�4��������ʱ��ϵ��ƽ����Է�������Ϊ(0.2��17+0.6��28)/(0.2+0.6)=25.25��
��1�������������������Ϊ98c1/(1000��1)=![]() ��
��
��2�����ʵ���Ũ��Ϊc1molL-1��������ˮ�������ϣ���Ϻ���Һ������仯���Բ��ƣ���������Һ�����ʵ���Ũ��ΪC1/2molL-1��
��3��������������ˮ�������ϣ�������Һ�����ʵ���Ũ��Ϊ0.6mol��L��1��������������Һ��������ϣ������ܶ�ǰ��<���ߣ���c2molL-1��ˮ������ϴ�����������Һ�����ʵ���Ũ�ȴ���0.6c2molL-1��


